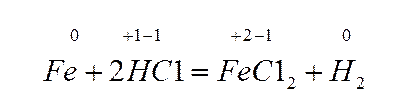
А эта реакция окислительно-восстановительная, т.к. железо и водород изменили степени окисления.
Процессы, происходящие в этой реакции, можно выразить уравнениями:
восстановитель ![]() окисление
окисление
окислитель ![]() восстановление
восстановление
Атомы железа отдают электроны, при этом степень окисления увеличивается от 0 до +2.
Процесс отдачи электронов называется окислением. Окисление сопровождается увеличением степени окисления.
Ионы водорода присоединяют электроны, их степень окисления уменьшается от +1 до 0.
Процесс присоединения электронов называется восстановлением. Восстановление сопровождается уменьшением степени окисления.
Вещества, молекулы (атомы, ионы) которых отдают электроны в процессе реакции, называются восстановителями, а вещества, молекулы (атомы, ионы) которых присоединяют электроны ‑- окислителями.
Число электронов, отданных в реакции восстановителем, равно числу электронов, присоединяемых окислителем.
Классификация реакций окисления-восстановления
Все окислительно-восстановительные реакции можно разделить на три группы: реакции межмолекулярного окисления-восстановления, реакции диспропорционирования (самоокисления-самовосстановления), реакции внутримолекулярного окисления-восстановления.
Реакция межмолекулярного окисления-восстановления. В таких реакциях обмен электронами происходит между различными атомами, молекулами и ионами. Таковы, например простейшие реакции соединения и замещения:
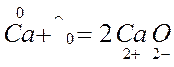
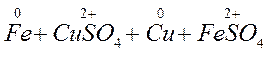
Степень окисления изменяется у меди и железа. Железо повышает степень окисления от 0 до +2, следовательно, является окислителем. Медь понижает степень от +2 до 0 и выступает в качестве восстановителя. Таким образом, обмен электронами происходит между атомами железа и ионами меди.
Реакции внутримолекулярного окисления-восстановления. Если нагревать кристаллический бихромат аммония, то произойдет бурная реакция по схеме:
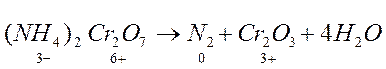
Степень окисления изменилась у хрома и азота. Хром понижает ее от +6 до +3, следовательно, является окислителем. Азот – восстановитель, т.к. повышает степень окисления от -3 до 0. Таким образом, в одной и той же молекуле содержится и окислитель, и восстановитель.
Реакции, в которых одна часть вещества выполняет функцию окислителя, другая – восстановителя, называются реакциями внутримолекулярного окисления-восстановления.
Реакции диспропорционирования (самоокисления-самовосстановления).
Азотистая кислота – вещество нестойкое и быстро разлагается по схеме:
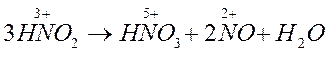
В реакциях диспропорционирования молекулы или ионы одного и того же вещества, содержащие атом с промежуточной степенью окисления, и повышают, и понижают ее, одновременно выступая и в качестве окислителя, и в качестве восстановителя.
В данном случае азот в степени окисления +3 и повысил ее до +5, и понизил до +2.
Ход работы:
Выполняя опыты, разобрать каждую ОВР, т.е.:
– составить схему ОВР;
– определить степени окисления атомов элементов, входящих в состав исходных и конечных веществ, выявить окислитель и восстановитель;
– составить электронные уравнения процессов окисления и восстановления, обеспечивающие электронный баланс;
– расставить стехиометрические коэффициенты в молекулярном уравнении ОВР;
– определить тип ОВР;
– охарактеризовать видимые признаки реакции.
Экспериментальная часть
Опыт 1. Вытеснение водорода из кислоты металлами.
В четыре пробирки налить по 2–3 мл раствора соляной кислоты. В одну пробирку внести кусочек магния, в другую – кусочек железа, в третью – кусочек меди, в четвертую – кусочек цинка.
Опыт 2. Вытеснение свинца цинком из раствора соли свинца.
В пробирку налить 2–3 мл раствора свинца (II) и внести кусочек цинка.
Опыт 3. Окислительные свойства перманганата калия.
В три пробирки налить по 1–2 мл раствора перманганата калия KMnO4. Затем в одну пробирку добавить 0,5–1 мл разбавленной серной кислоты, в другую – 0,5–1 мл воды, в третью – 0,5–1 мл раствора гидроксида калия. После этого во все пробирки добавлять по каплям раствор натрия до изменения окраски раствора.
Опыт 4. Окислительные свойства бихромата калия.
В пробирку налить 1–2 мл бихромата калия K2Cr2O7, 0,5–1 мл серной кислоты и добавлять по каплям раствор сульфита Na до изменения окраски раствора.
Опыт 5. Взаимодействие сульфата марганца (II) c перманганатом калия.
В пробирку налить 1–2 мл раствора сульфата Mn и добавлять по каплям раствор перманганата калия до изменения окраски раствора до желто-коричневого. Написать уравнение реакции учитывая, что Mn2+ и Mn7+ переходят в Mn4+.
Опыт 6. Разложение нитрата меди (вытяжной шкаф).
В пробирку поместить несколько кристаллов нитрата меди (II). Закрепить пробирку в штативе и осторожно нагревать малым пламенем. Написать уравнение реакции разложения нитрата меди учитывая что, продуктами являются оксид меди (II), оксид азота (IV) и кислород.
Лабораторная работа №8
Электролиз в растворах
Цель работы:
Ознакомиться с процессом электролиза в растворах и получить навыки составления уравнения электролиза.
Введение
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.