Экспериментальная часть
Опыт 1. Смещение равновесия обратимой реакции между хлорным железом и роданидом калия.
Для опыта используйте обратимую реакцию:
![]()
Вводные растворы участвующие в реакции солей имеют различную окраску, поэтому изменение концентрации реагирующих веществ приведет к изменению окраски реакционной смеси. Это позволит наблюдать, в каком направлении будет смещаться равновесие при изменении концентрации реагирующих веществ.
Рассмотрите растворы солей и запишите в таблицу 9 их окраску.
Таблица 9
|
Раствор |
FeCl3 |
KCNS |
Fe(CNS)3 |
KC1 |
|
Окраска |
В небольшом стаканчике смешайте 20 мл воды, 1–2 капли насыщенного раствора хлорного железа FeCl3 и 1–2 капли насыщенного раствора роданида калия KCNS. Полученный раствор перемешайте стеклянной палочкой и разлейте в четыре пробирки. Одну пробирку с полученным раствором оставьте для сравнения результатов опыта. В остальные пробирки добавьте следующие реактивы: во вторую – 1–2 капли насыщенного раствора FeCl3, в третью – 1–2 капли насыщенного раствора KCNS, в четвертую – 2–3 г кристаллического KC1. Сравните интенсивность окраски полученных растворов с интенсивностью окраски эталона.
Напишите выражение для константы равновесия наблюдаемой реакции. Запишите в таблицу 10 свои наблюдения, определите направления смещения равновесия и связанные с ним изменения в растворах.
Таблица 10
|
N пробирки |
Добавка реактива |
Наблюдаемое изменение окраски |
Направление смещения равновесия |
Характер изменения концентрации компонентов по сравнению с их первоначальными равновесия концентрациями |
|||
|
Fe(CNS)3 |
KC1 |
FeCl3 |
KCNS |
||||
|
1 |
|||||||
|
2 |
FeCl3 |
||||||
|
3 |
KC1 |
||||||
|
4 |
KCNS |
||||||
Опыт 2. Смещение химического равновесия в растворе бихромата калия.
В растворах, содержащих соли хрома Cr(V1),
существует равновесие между ионами хромата ![]() и
бихромата
и
бихромата ![]()
![]()
Изменение концентрации водородных ионов смещает это равновесие, что можно обнаружить по изменению окраски раствора.
Для проведения опыта в пробирку налейте 3–5 мл 10% раствора бихромата калия K2Cr2O7. К этому раствору по каплям добавьте концентрированных раствор щелочи и наблюдайте изменение окраски. Затем в этот же раствор добавьте по каплям концентрированную серную кислоту и наблюдайте изменение окраски.
Запишите свои действия и наблюдения и объяснения и объясните причины изменения окраски раствора. Укажите направление смещения равновесия в первой и втором случае.
Лабораторная работа №7
Окислительно-восстановительные реакции
Цель:
Ознакомиться с различными типами окислительно-восстановительных реакций (ОВР) и получить навыки составления уравнений ОВР.
Введение
Реакции, в процессе которых происходит существенное перераспределение электронной плотности между реагирующими частицами (ионами, атомами, молекулами) с изменением степени окисления элементов, называются окислительно-восстановительными.
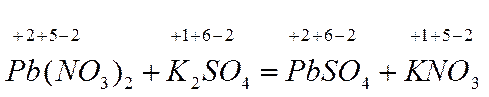
Эта реакция не является окислительно-восстановительной, т.к. не произошло изменение степени окисления элементов.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.