2 МОЛЕКУЛЯРНА ФІЗИКА І ТЕРМОДИНАМІКА
Основні формули
Кількість речовини однорідного газу (у молях)
n 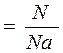 ,
n
,
n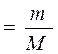 ,
,
де N- число молекул; Nа – стала Авогадро; m- маса газу;
М – молярна маса.
Якщо система є суміш’ю декількох газів, тоді кількість речовини системи
n = n 1+ n 2+n 3….+ nn ,
n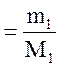
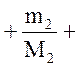 ….
….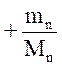 ,
,
де nі, Nі, mі, Mі – відповідно кількість речовини, число молекул, маса, молярна маса і –ої компоненти суміші.
Рівняння Менделєєва-Клапейрона (рівняння стану ідеального газу)
PV ![]() RT = nRT,
RT = nRT,
де m – маса газу ; М – молярна маса; R = 8.31 Дж/(моль . К) - універсальна газова стала; n – кількість речовини; Т – термодинамічна температура.
Експериментальні газові закони, які є окремими випадками рівняння Менделєєва-Клапейрона для ізопроцесів
а) закон Бойля –Маріотта (ізотермічний процес – Т = const, m = const )
PV = const,
або для двох станів газу
P1 V1 =P2V2;
б) закон Гей-Люсака (ізобарний процес –p = const, m = const)
V = VoaT ,
або для двох станів
![]() =
= ![]() ;
;
в) закон Шарля (ізохорний процес – V = const, m = const )
P = PoaT ,
або для двох станів
![]() =
=![]() ;
;
г) об’єднаний газовий закон ( m = const)
![]() = const, абo
= const, абo 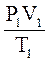 =
=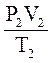 ,
,
де P1, V1, T1 - тиск, об’єм і температура газу в початкому стані; P2, V2, T2- ці ж параметри в кінцевому стані.
Закон Дальтона визначає тиск суміші газів
P = P1+P2+...+P n ,
де - Pі - парціальні тиски компонентів суміші; n - число компонентів.
Парціальний тиск - тиск, який створював би цей газ, якщо б тільки він один знаходився в посудині, зайнятій суміш’ю.
Молярна маса суміші газів
М =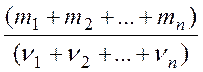 ,
,
де mi - маса і-го
компонента суміші; νi = ![]() -
кількість речовини i-го
компонента; n- число компонентів.
-
кількість речовини i-го
компонента; n- число компонентів.
Концентрація молекул
n =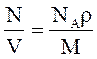 ,
,
де N - число молекул, які знаходяться в даній системі;
r - густина речовини;
V - об’єм системи. Формула може використовуватись не тільки для газів, але і для любого агрегатного стану речовини.
Основне рівняння кінетичної теорії газів
P 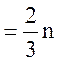 <eк>,
<eк>,
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.