і - число ступенів свободи молекули газу;
М - молярна маса.
Для неону і = 3, а М=20 . 10-3 кг/моль
Виконаємо розрахунки
сv 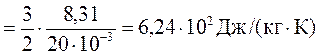
c![]()
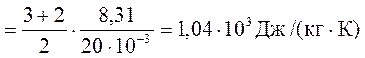
Для водню (двохатомний газ) і = 5, а М = 2 . 10-3 кг/моль
Тоді
сv = 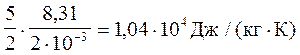
с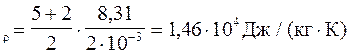
Приклад 6. Обчислити питомі теплоємності сv та ср суміші неону і водню, якщо масові долі неону та водню складають w1 = 80 % і w2 = 20 %. Значення питомих теплоємностей газів взяти з попереднього прикладу.
Розв’язання
Питому теплоємність сv суміші при сталому об’ємі знайдемо так. Спочатку знайдемо теплоту для нагрівання суміші таким способом
Q = cv (m1 + m2)DT , (1)
а потім по слідуючій формулі
Q = ( cv1m1 + cv2m2) DT, (2)
де сv1 - питома теплоємність неону;
сv2 - питома теплоємність водню.
Прирівняємо праві частини (1) і (2) і поділимо обидві частини нового рівняння на DT і будемо мати
сv (m1 + m2) = cv1m1 + cv2m2,
тоді
сv =cv1 w1 + cv2w2,
де
w1 = 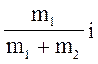 ,
,
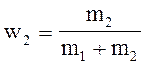 .
.
Таким же способом можна одержати формулу для обчислення питомої теплоємності суміші при сталому тиску.
сr= сr1w1 + cr2w2![]()
Виконаємо розрахунки і одержимо
cv = (6.24 • 10 2•0,8 + 1,04 • 104 •0,2) = 2,58 кДж /(кг • К)
сr = ( 1,04 • 103 • 0,8 + 1,46 • 0,2) = 3,75 кДж/(кг•К)
Приклад 7. Кисень масою m =2 кг займає об’єм V1 = 1 м3 і знаходиться під тиском Р1 = 0,2 МПа. Газ нагріли спочатку при сталому тиску до об’єму V2 = 3 м3, а потім при сталому об’ємі до тиску Р3 = 0,5 МПа. Знайти змінення DU внутрішньої енергії газу, виконану ним роботу А і теплоту Q, яку передано газу. Накреслити графік процесів.
Розв’язання
Змінення внутрішньої енергії газу
DU = cvmDT 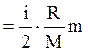 DT,
DT,
де і - число ступенів свободи молекул газу (для двохатомних молекул кисню і = 5 );
DТ = Т3 - Т1 різниця температур газу в кінцевому (третьому) та початковому станах. Початкову і кінцеву температури газу знайдемо з рівняння Менделєєва-Клапейрона
РV = (![]()
![]() ) RT, звідки
Т
) RT, звідки
Т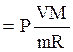
Роботу розширення газу при сталому тиску можно записати формулою
А1 =(![]() ) RDT.
) RDT.
Робота газу при сталому об’ємі дорівнює нулю, тобто
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.