Підставимо m1, а потім m2 у (2) - тоді
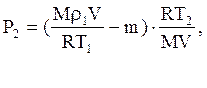
або
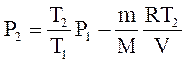 (4)
(4)
Перевіримо одиниці вимірювання р2:
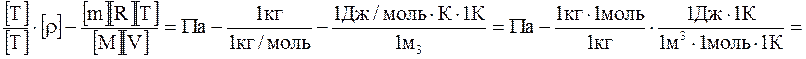
=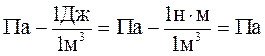
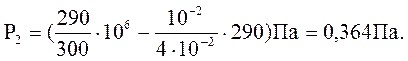
Приклад 3. Балон має m1 = 80 г кисню і m2=230 г аргону. Тиск суміші Р=1 МПа, температура Т = 300 К. Визначити ємність балону, якщо гази ідеальні.
Розв’язання
Використовуючи рівняння Менделєєва-Клапейрона, знайдемо Р1 і Р2.
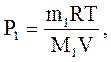
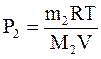
По закону Дальтона для суміші газів
Р![]() або
або 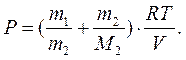
Тоді ємність балону
V =(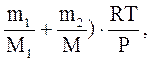 (1)
(1)
де М1 = 32 . 10-3 кг/моль , М2 = 40 . 10-3 кг/моль
V = 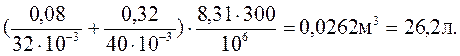
Приклад 4. Знайти середню кінетичну енергію <e оберт. > обертального руху однієї молекули кисню при температурі 350 К, а також кінетичну енергію Ек обертального руху усіх молекул кисню масою m = 4 г.
Розв’язання
На кожну ступінь свободи молекули газу припадає однакова середня енергія <eі>=1/2kT , (1)
де k - стала Больцмана;
Т - термодинамічна температура газу.
Молекула кисню двохатомна і тому має п’ять ступенів свободи, з них 2 припадає на обертальний рух, тобто
<eоберт.> = 2 . 1/2 kT
Кінетична енергія обертального руху всіх молекул газу відповідно дорівнює
Ек =<eоберт> . N (2)
Число всіх молекул газу
N = NA .n, (3)
де NA - cтала Авогадро;
n - кількість речовини.
Тоді формула (3) буде мати вигляд
N = NA . ![]()
Якщo N поставити в рівняння (2), то одержимо
Ек =NA .![]() <eоберт>.
<eоберт>.
<eоберт.> = 1,38 . 10-23 .350 = 4,83 . 10-21 Дж.
Ек = 6,02 . 1023 6. 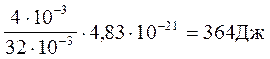
Приклад 5.Обчислити питомі теплоємності при незмінному об’ємі сv і при сталому тиску ср неону та водню, вважаючи ці гази ідеальними.
Розв’язання
Питомі теплоємності ідеальних газів можна обчислити за формулою
сv= 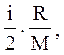
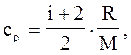 (1)
(1)
де
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.