Данные, показанные на нижней панели Рис. 3, указывают на существенное уменьшение взаимодействия меди с фульвокислотой в присутствии ионов магния. Прямой конкуренции между ионами меди и магния нет, поскольку снижение степени закомплексованности меди наблюдается при увеличении концентрации кальция или магния до 3 mM, тогда как дальнейшее увеличение концентрации щелочноземельных металлов уже не оказывает никакого влияния. По всей видимости, щелочноземельные металлы взаимодействуют не с фенольными, а с карбоксильными группами:
(Ca, Mg)2+ + HL—COO- ó HL—COO(Ca, Mg)+ [10]
Константа этого равновесия равна, приблизительно, 104 (приведенная к количеству карбоксильных групп, равному 1 ммоль/г), поэтому в большинстве природных вод (Сa+Mg ³ 0.5e-4 M) гумусовые вещества более чем на 80 % состоят из гуматов и фульватов кальция и магния. Вероятно, гуматы и фульваты кальция и магния взаимодействуют с тяжелыми металлами подобно гумусовым кислотам, например:
Сu2+ + HLs—COOCa+ ó CuLs+—COOCa+ + H+ [11]
Сu2+ + HLw—COOCa+ ó CuLw+—COOCa+ + H+ [12]
Взаимодействие меди с фульватами и гуматами щелочноземельных металлов проявлено в 5 раз слабее. Чтобы не умножать сущностей без надобности, можно воспользоваться валовыми константами реакций [8,9], вводя поправки на щелочность и ионную силу:
lgKøMeL = lgKoMeL + U – 2 ∙ D [13]
U = lg{(1+0.2[Ca+Mg] · KøCaHL)/(1+[Ca+Mg] · KøCaHL)} [14]
lgKøCaHL = lgKoCaHL – 4 ∙ D (lgKoCaHL = 4.0; D – см. уравнение [4]) [15]
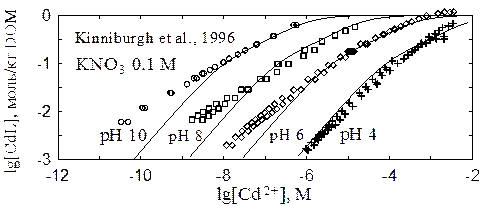 Здесь
и далее, символ Kø соответствует условной константе (отношение
концентраций, справедливое при данной ионной силе и/или других условиях), тогда
как символ Ko отвечает термодинамической константе равновесия
(отношение активностей).
Здесь
и далее, символ Kø соответствует условной константе (отношение
концентраций, справедливое при данной ионной силе и/или других условиях), тогда
как символ Ko отвечает термодинамической константе равновесия
(отношение активностей).
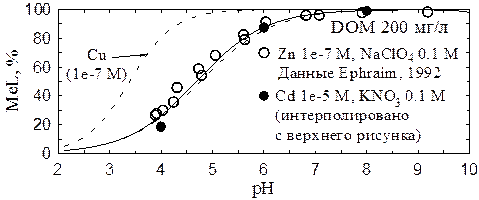
|
Cd2+ + HLs ó CdLs+ + 0.65H+ и [16]
Cd2+ + HLw ó CdLw+ + 0.65H+ . [17]
В этих реакциях не соблюдается баланс масс, поэтому данная запись является бессмысленной. Однако эти реакции дают удовлетворительное описание экспериментальных данных (если принимать в расчет нелабильность комплексов CdL+). Параметры гетерогенности оказываются теми же самыми, что и при взаимодействии с ионами меди (сильные и слабые фенольные группы соотносятся как 1 : 4, разность логарифмов констант составляет 1.6 лог. ед.). Не вкладывая особого смысла, поправки к константам реакций [16,17] на ионную силу и жесткость можно вводить в согласии с уравнениями [13-15].
На нижней панели Рис. 4 показаны данные по взаимодействию ионов цинка с фульвокислотой (Ephraim, 1992). Данные были получены путем измерения коэффициента распределения радиоизотопа 65Zn между раствором и ионнообменной смолой, поэтому низкое значение общей концентрации цинка (10-7 М) не вносило искажений в результаты измерений. Данные удовлетворительно воспроизводятся при помощи тех же модельных параметров, что и данные по кадмию. Для сравнения на Рис. 4 приведены данные по кадмию и расчетные кривые для кадмия и меди в похожих условиях.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.