Кривые титрования гумусовых веществ обнаруживают две ступени ионизации, первая при рН 2-7, и вторая в щелочной области. В связи с этим, выделяют условно карбоксильные и условно фенольные группы, которые отщепляют протоны в кислой и щелочной области рН, соответственно.
Содержание карбоксильных групп в фульвокислотах составляет 5-6 ммоль/г, а в гуминовых кислотах их содержание обычно в 1.5-2 раза ниже. Содержание фенольных групп неизвестно, однако имеется некоторое ощущение, что их количество меньше количества карбоксильных групп.
Двухступенчатый характер диссоциации гумусовых веществ можно обозначать символом (HL)n—R—(COOH)m, где HL и COOH – фенольная и карбоксильная группы, n и m – количества этих групп, а R – углеводородная цепочка.
Переменность состава, наличие молекул с различной молекулярной массой, а также огромное количество разнообразных химических реакций, делают классический подход к описанию поведения подобных полиэлектролитов практически непригодным. По этой причине обычно выделяют минальную группировку гумусового вещества, HL—COOHm/n, поведение которой описывают небольшим набором констант с учетом, либо без учета электростатических взаимодействий.
2.2. Взаимодействие с тяжелыми металлами
Взаимодействие тяжелых металлов с гумусовыми веществами оказывает основное влияние на поведение растворенных тяжелых металлов в природных водах. Исследованию этого влияния посвящено значительное число работ. Наиболее подробную библиографию и выборочную компиляцию экспериментальных данных по этому вопросу можно найти в работах (Tipping and Hurley, 1992; Tipping, 1998).
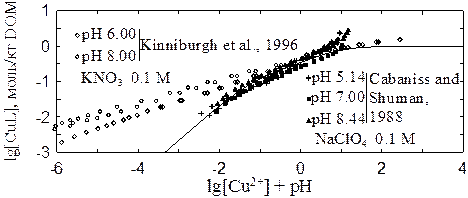 Изучение
взаимодействия тяжелых металлов с растворенным органическим веществом сопряжено
с определенными трудностями. Дело в том, что большинство работ выполняется при
помощи ионоселективных электродов, которые надежно работают лишь при pMe<6.
При более низкой концентрации свободных ионов или простых комплексов
электродная функция пропадает.
Изучение
взаимодействия тяжелых металлов с растворенным органическим веществом сопряжено
с определенными трудностями. Дело в том, что большинство работ выполняется при
помощи ионоселективных электродов, которые надежно работают лишь при pMe<6.
При более низкой концентрации свободных ионов или простых комплексов
электродная функция пропадает.
|
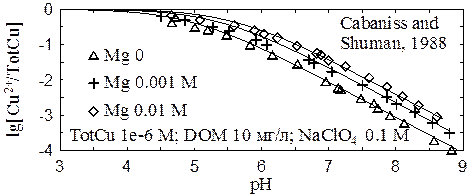 На рис. 3 (верхняя панель) показаны данные
по взаимо-действию меди с растворенным органическим веществом (Kinniburgh et
al., 1996; Cabaniss and Shuman, 1988). Основным различием гумусовой кислоты и
фульвокислоты, использованных в этих работах, является молекулярный вес (23000
г/моль для гумусовой кислоты и около 1000 г/моль для фульвокислоты). Данные
показывают, что при взаимодействии меди с гумусо-выми кислотами образуются
электрохимически инертные
На рис. 3 (верхняя панель) показаны данные
по взаимо-действию меди с растворенным органическим веществом (Kinniburgh et
al., 1996; Cabaniss and Shuman, 1988). Основным различием гумусовой кислоты и
фульвокислоты, использованных в этих работах, является молекулярный вес (23000
г/моль для гумусовой кислоты и около 1000 г/моль для фульвокислоты). Данные
показывают, что при взаимодействии меди с гумусо-выми кислотами образуются
электрохимически инертные
(«нелабильные») комплексы. По этой причине большая часть данных, полученных в работе (Kinniburgh et al., 1996), не имеет смысла. Напротив, данные работы (Cabaniss and Shuman, 1988) указывают на лабильный характер комплексов меди с фульвокислотами. Следует заметить, что в каждом случае лабильность или нелабильность комплекса зависит как от специфики органического вещества, так и от характеристик ионоселективного электрода.
Карбоксильные группы, обладающие сравнительно сильными кислотными свойствами, являются слабыми комплексообразователями. Наоборот, фенольные группы весьма прочно связывают тяжелые металлы. Взаимодействие меди с фенольными группами гумусовых веществ можно описать равновесиями:
Cu2+ + HLs ó CuLs+ + H+ и [8]
Cu2+ + HLw ó CuLw+ + H+ . [9]
Здесь HLs и HLw – «сильные» (strong) и «слабые» (weak) фенольные группы. Соотношение «сильных» и «слабых» фенольных групп близко к 1 : 4, а различие в константах этих реакций составляет около 1.6 лог. ед.
Общая сорбционная емкость органического вещества близка к 1 ммоль/г. Поскольку содержание карбоксильных групп органического вещества составляет 3-6 ммоль/г, отношение содержаний карбоксильных и фенольных групп должно быть близким к 3-6. Это означает, что общий заряд органического вещества насыщенного тяжелыми металлами остается отрицательным (заряд комплекса CuL+ соответствует заряду функциональной группы, но не заряду молекулы в целом). Однако в присутствии ионов щелочноземельных металлов отрицательный заряд органического вещества падает, и образование комплексов CuL+ в значительной степени подавляется.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.