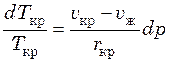 , (41.1)
, (41.1)
где ![]() –
температура кристаллизации;
–
температура кристаллизации; ![]() – удельные объемы
кристаллической и жидкой фаз;
– удельные объемы
кристаллической и жидкой фаз; ![]() – удельная теплота
кристаллизации;
– удельная теплота
кристаллизации; ![]() – давление.
– давление.
Для большинства веществ ![]() , поэтому для них
температура кристаллизации при увеличении давления возрастает. Для воды и
некоторых других веществ
, поэтому для них
температура кристаллизации при увеличении давления возрастает. Для воды и
некоторых других веществ ![]() , и температура
кристаллизации для них уменьшается с ростом давления.
, и температура
кристаллизации для них уменьшается с ростом давления.
Характер поведения расплавов индивидуальных веществ при их охлаждении представлен на рис. 41.4.
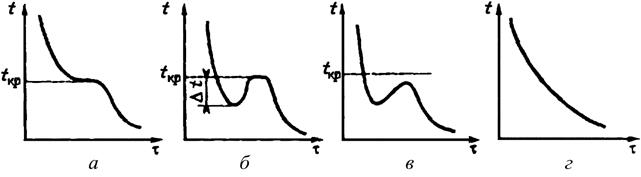
Рисунок 18.4 – Температурный график
охлаждения расплавов:
а – кристаллизация без переохлаждения; б, в –кристаллизация
при небольшом и
значительном переохлаждениях; г –затвердевание аморфных веществ.
При постепенном охлаждении расплавов индивидуальных веществ температура ![]() в точке кристаллизации и в идеале остается
постоянной во времени до тех пор, пока весь расплав не закристаллизуется (рис. 41.4, а).
Дальнейший отвод тепла приводит к снижению температуры. Такое поведение
расплава происходит в тех случаях, когда при температуре кристаллизации в
расплаве сразу возникают центры кристаллизации или когда в расплав вводят
подготовленные центры кристаллизации (затравку)
в точке кристаллизации и в идеале остается
постоянной во времени до тех пор, пока весь расплав не закристаллизуется (рис. 41.4, а).
Дальнейший отвод тепла приводит к снижению температуры. Такое поведение
расплава происходит в тех случаях, когда при температуре кристаллизации в
расплаве сразу возникают центры кристаллизации или когда в расплав вводят
подготовленные центры кристаллизации (затравку)
На практике ход температурной кривой как правило отличается от идеального
из-за переохлаждения жидкой фазы ниже точки кристаллизации на величину ![]() (рис. 41.4, б). Если
переохлаждение небольшое, то при появлении центров кристаллизации начнется
процесс выделения кристаллов, и за счет выделяющейся теплоты температура
вещества может повыситься до температуры кристаллизации. При сильном
переохлаждении жидкой фазы выделившейся теплоты может оказаться недостаточно
для повышения температуры до равновесного значения
(рис. 41.4, б). Если
переохлаждение небольшое, то при появлении центров кристаллизации начнется
процесс выделения кристаллов, и за счет выделяющейся теплоты температура
вещества может повыситься до температуры кристаллизации. При сильном
переохлаждении жидкой фазы выделившейся теплоты может оказаться недостаточно
для повышения температуры до равновесного значения ![]() (рис. 41.4, в).
При охлаждении расплавов аморфных веществ не происходит выделения теплоты
фазового перехода, поэтому температура системы монотонно изменяется во времени
(рис. 41.4, г).
(рис. 41.4, в).
При охлаждении расплавов аморфных веществ не происходит выделения теплоты
фазового перехода, поэтому температура системы монотонно изменяется во времени
(рис. 41.4, г).
Температурные кривые при плавлении твердых веществ аналогичны кривым для кристаллизации. Отличие состоит в том, что плавление начинается при достижении температуры кристаллизации, т.е. без перегрева кристаллической фазы.
Анализ условий равновесия и выбор способа кристаллизации удобно проводить с помощью фазовых диаграмм в координатах концентрация –температура (рис. 41.5), которые приводятся в справочной литературе. На такой диаграмме можно выделить три области.
Область разбавленных растворов В, в которой не происходит кристаллизации; метастабильную или относительно устойчивую область Б и лабильную или неустойчивую область А, в которой происходит массовая кристаллизация.
Рисунок41.5 – Диаграммы состояния
растворов:
А – область лабильных растворов; Б ‑ область метастабильных
растворов;
В – область разбавленных растворов.
Для веществ с крутой зависимостью растворимости от температуры (рис. 41.5, а),
при незначительном снижении температуры насыщенного раствора от ![]() , состояние раствора соответствует вначале
метастабильной области на участке от
, состояние раствора соответствует вначале
метастабильной области на участке от ![]() до
до ![]() , а затем – области пересыщенных
растворов, где происходит выделение твердой фазы. После этого раствор снова
становится насыщенным и его концентрация изменяется по линии от
, а затем – области пересыщенных
растворов, где происходит выделение твердой фазы. После этого раствор снова
становится насыщенным и его концентрация изменяется по линии от ![]() до
до ![]() .
Следовательно, кристаллизацию таких растворов целесообразно проводить их
охлаждением.
.
Следовательно, кристаллизацию таких растворов целесообразно проводить их
охлаждением.
Для солей, растворимость которых более медленно возрастает с увеличением
температуры (рис. 41.5, б), переход в область пересыщенных
растворов (из точки ![]() в точку
в точку ![]() )
происходит только при значительном снижении температуры. Кроме охлаждения
раствора, состояние пересыщения в этом случае может быть быстро достигнуто
путем испарения части растворителя при постоянной температуре, а концентрация
раствора при этом изменится от точки
)
происходит только при значительном снижении температуры. Кроме охлаждения
раствора, состояние пересыщения в этом случае может быть быстро достигнуто
путем испарения части растворителя при постоянной температуре, а концентрация
раствора при этом изменится от точки ![]() до точки
до точки ![]() . Для таких растворов способ
кристаллизации выбирают на основании технико-экономического расчета.
. Для таких растворов способ
кристаллизации выбирают на основании технико-экономического расчета.
Если растворимость соли практически не зависит от температуры (рис. 41.5, в),
то в этом случае кристаллизацию осуществляют путем испарения растворителя с
изменением концентрации раствора по линии ![]() .
.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.