где φ – влагосодержание; rв – теплота плавления воды; h271 – энтальпия материала до начала дефростации.
Переход на использование в вычислениях энтальпий требует изменения методики расчетов. При замене производных разностными приближениями [2] уравнение энергии примет вид:
![]() , (6)
, (6)
где hi , hi¢ – соответственно текущее и последующее значение энтальпии в ί-точке; qi+1 , qi-1 – соответственно тепловой поток от предыдущей и последующей точек; qv – тепловой поток от внутренних источников в объеме, отнесенном к ί-точке.
В рассматриваемой модели отсутствуют внутренние источники теплоты, т.е. не происходит химических превращений или физиологических процессов способных выделить теплоту, по этому:
![]() , (7)
, (7)
После этого допущения можно разбить объект криогенного замораживания на систему из элементарных цилиндров и рассмотреть теплоту, поступающую к цилиндрам с центральной части к периферии объекта при помощи классических уравнений теплопроводности. Внешний подвод теплоты от точки расположенной за пределами рассматриваемого участка описывается выражением (8), а тепловой поток, подводимый из внутренней части к элементарному цилиндру описывается выражением (9).
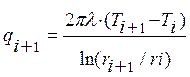 , (8)
, (8)
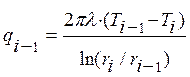 , (9)
, (9)
Решение дифференциального уравнения энергии предполагает в себе определение величины тепловых потоков поступающих к рассматриваемому объекту с его границ т.к. объект замораживания представляет собой цилиндр то граница у этого цилиндра одна – эта граница объекта замораживания с ампулой контейнера, в котором он находится. Обмен между ампулой и объектом консервирования происходит в конвективном режиме [2]. Интенсивности конвективной передачи теплоты описывается эффективным коэффициентом α*:
qi+1 = a*×F×( Tк - Ti ), (10)
Для центрального участка выполняются все расчеты, с тем условием, что объект, от которого она могла получить теплоту, отсутствует:
qi‑1 = 0, (11)
Решение дифференциального уравнения сводится к определению
изменения энтальпий всех материальных точек для каждого последующего момента
времени. Новое значение энтальпии обозначаем ![]() , и
вычисляем его из материального баланса элементарной точки:
, и
вычисляем его из материального баланса элементарной точки:
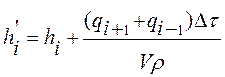 . (12)
. (12)
После расчета новых значений энтальпий необходимо определить соответствующие этим новым значениям значения температур Ti' =f ( hi' ). Специфика решаемой задачи состоит в том, что объект криоконсервации может находиться в одном из трех энергетических состояний:
1.
Состояние первичного
переохлаждения, когда температура объекта изменяется от температуры близкой к
температуре окружающей среды до температуры начала кристаллизации. ![]() .
.
2.
Состояние кристаллизации или
дефростации, когда при постоянной температуре происходит изменение энтальпии за
счет отвода (подвода) теплоты кристаллизации. ![]() .
.
3.
Если объект подвергается
переохлаждению от температуры дефростации до температуры прекращения замораживания.![]() .
.
Для материла в замороженном состоянии при hi'< h271 температура определяется из выражения:
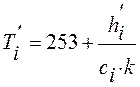 , (13)
, (13)
где Т=253К – точка начала отсчета энтальпий.
Коэффициент к=0,5 учитывает, что в замороженном состоянии теплоемкость воды снижается в два раза.
На участке дефростации (14) температура постоянна Ti = const или Ti = 271 K.
h271< hi'< h271+ φ rв , (14)
где h271 - минимальная энтальпия вещества подвергаемого дефростации;
φ·rв - теплота фазового перехода.
Для незамороженного слоя материала, т. е. при условии, что:
hi' > h271 + φ rв, (15)
температура определится из выражения:
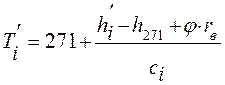 , (16)
, (16)
Моделируемая система, состоит из двух объектов охлаждения: препарата и контейнера. Для того чтобы математические вычисления не сопровождались ошибками, расчет тепловых полей в контейнере оформлен в виде самостоятельного модуля. При этом используется уравнение энергии (3), которое было применено при рассмотрении процессов протекающих в самом препарате.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.