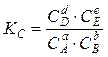 и
и
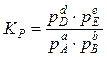 ,
,
где Сi и pi – соответственно равновесные концентрации и парциальные давления. Константа равновесия не зависит ни от давления, ни от концентрации, а определяется только природой реагирующих веществ и температурой.
Чем значительнее убыль энергии Гиббса, тем больше величина константы равновесия. Математически эта связь выражается зависимостью:
rG°Т = - R·T·lnK, (16)
позволяющей по величине rG°Т вычислить К.
3. Содержание расчетной работы
3.1. Задание 1. Термодинамический расчет
теплового эффекта химической реакции
Необходимо рассчитать для Вашего варианта физико-химической системы значения энтальпий химической реакции (в Дж/моль) при 298 К и заданной температуре, а также определить тепловой эффект химической реакции (в Дж) - количество выделенной или поглощенной энергии с учетом числа молей, участвовавших в реакции (определить по количеству указанного вещества).
3.2. Задание 2. Расчет изменения энтропии химической реакции
Необходимо по уравнениям (10) – (12), приведенным в разделе 2.3, рассчитать изменение энтропии при протекании в Вашей физико-химической системе химической реакции при 298 К и при заданной температуре.
3.3. Задание 3. Расчет изменения энергии Гиббса
химической реакции
Используя полученные в предыдущих заданиях значения энтальпии и изменения энтропии химической реакции определить величины изменения энергии Гиббса при 298 К и при заданной температуре и сделать выводы о возможности протекания химической реакции в указанных условиях. В случае невозможности химического взаимодействия в Вашей физико-химической системе при каких-либо условиях, необходимо оценить величину температуры начала реакции по уравнению (15) и сделать физически оправданный вывод.
3.4. Задание 4. Термодинамический расчет
константы равновесия химической реакции
Используя полученные в задании 3 результаты определить по уравнению (16) величины констант равновесия химических реакций при 298 К и при заданной температуре и сделать общий вывод по всей расчетной работе.
4. Рекомендуемая литература
1. Рузавин Г.И. Концепции современного естествознания. – М.: ЮНИТИ, 2000. – 288 с.
2. Еремин В.В., Каргов С.И., Успенская И.У., Кузьменко Н.Е., Лунин В.В. Основы физической химии. Теория и задачи. – М.: Экзамен, 2005 . – 480 с.
3. Краткий справочник физико-химических величин / Ред. А.А. Равдель, А.М. Пономарева. – Л: Химия, 1983. – 232 с.
Приложение 1
Таблица 2
Термодинамические свойства веществ в стандартных условиях
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.