Изменение теплоемкости физико-химической системы в результате протекания в ней реакции определяется как результат суммирования степенного выражения (6) для температурной зависимости теплоемкости каждого из участников реакции со своим знаком (для исходных веществ – знак "минус", для продуктов реакции – знак "плюс") с учетом стехиометрических коэффициентов ni по уравнению:
rСР = SniСР прод. - SniСР исх., (7)
а полученный результат представляется в виде:
DCP = Da + DbТ + DcT-2, (8)
где Da,Db, Dc – изменение величин степенных коэффициентов физико-химической системы при протекании в ней химической реакции.
После подстановки выражения (8) в уравнение (5) и интегрирования получаем выражение для расчета зависимости энтальпии химической реакции от температуры
DH°T = DH°298 +Da·(T-298)+0,5Db·(T2-2982)-Dc·(T-1-298-1). (9)
Размерность полученной энтальпии химической реакции – кДж/моль. Для расчета величины теплового эффекта данной химической реакции, протекающей в условиях, указанных в таблице 1 для Вашего варианта, необходимо определить число молей веществ, участвующих в реакции. Напомним, что моль (или грамм-моль) - это количество вещества, равное его молекулярной массе, выраженной в гаммах. Поэтому указанное в таблице 1 количество одного из компонентов необходимо пересчитать в число молей и полученное по (9) значение энтальпии реакции умножить на рассчитанное число молей. Определение количества молей для газообразных веществ упрощается тем, что один моль любого газа при нормальных условиях занимает объем в 22,4 литра. В некоторых химических реакциях указанное в таблице количество вещества при расчете числа молей необходимо уменьшить, разделив на величину стехиометрического коэффициента перед формулой этого вещества в химической реакции; например, такое деление на 3 необходимо провести при определении числа молей, участвующих в реакции по данным для FeO в первой реакции в таблице 1.
Энтальпия реакции дает возможность рассчитать, какое количество теплоты выделится или поглотится при протекании реакции, но не позволяет определить возможность ее самопроизвольного протекания в конкретных условиях.
2.3. Изменение энтропии химической реакции
Второй закон термодинамики позволяет определить возможность протекания самопроизвольного процесса в физико-химической системе. В формулировке Р. Клаузиуса утверждается, что "в изолированной системе энтропия самопроизвольно возрастает до своего максимального значения. Максимальному значению энтропии в изолированной системе соответствует состояние равновесия".
Энтропия является мерой неупорядоченности системы, ее однородности, мерой хаоса в ней. Энтропия твердого тела – кристалла меньше, чем энтропия жидкости, а энтропия газа больше энтропии жидкости (рисунок 2).
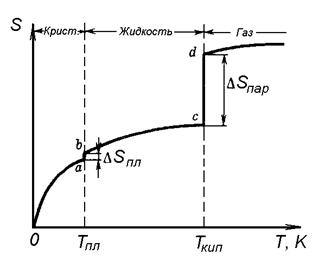
Рисунок 2. Зависимость энтропии вещества от температуры
С повышением температуры энтропия вещества монотонно возрастает, а при фазовых превращениях, например при плавлении (линия a-b на рис. 2) и испарении (линия c-d на рис. 2) она повышается скачкообразно. Изменение энтропии при фазовых переходах (ΔSпл. и ΔSпар.) рассчитываются как отношение энтальпии фазового перехода к абсолютной температуре, при которой он происходит: ΔSф.п. = ΔН ф.п./Тф.п.
Из рисунка 2 видно, что при температуре 0 К энтропия вещества равна нулю. Это утверждение следует из третьего закона термодинамики и позволяет рассчитывать абсолютные величины энтропии вещества. Поэтому в справочниках термодинамических величин [3] и в таблице 2 (Приложение 1) приведены стандартные значения абсолютных энтропий веществ Sº.
Энтропия является функцией состояния системы, поэтому ее изменение при протекании химических реакций в изотермических условиях вычисляется как разность сумм энтропий продуктов реакции и сумм энтропий исходных веществ с учетом их стехиометрических коэффициентов по аналогии с энтальпий химической реакции:
rS°реак. = SniS° прод. - SniS° исх., (10)
где S- условное обозначение суммы. Например, для реакции
аА + bВ ® сС + dD,
rS°реак. = (cS°C + dS D) - (aS°A + bS°B),
где А, В и С, D – исходные вещества и продукты реакции, соответственно;
а, b, с, d - соответствующие стехиометрические коэффициенты в уравнении реакции;
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.