2(ЕО + 2b) + 4(ЕО + b) = 6ЕО + 8b. (11.12)
Разница с вариантом локализации между двумя атомами углерода пары электронов по структуре Кекуле (3 пары) составляет 2b. Это и есть энергия делокализации, приведённая в табл.11.1 (первая строка второго столбца). Распределение электронных уровней представлено на рис.11.5.
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() 0
0
Е Е
ЕО-2b
ЕО-1.62b
L=-1 L=+1
![]()
![]()
![]() ЕО-b ЕО-b
ЕО-b ЕО-b
ЕО-0.62b
ЕО
![]()
![]()
![]() L=-1
L=+1 ЕО+0.62b
L=-1
L=+1 ЕО+0.62b
ЕО+b ЕО+b
ЕО+1.62b
ЕО+2b
Бензол Бутадиен
Рис.11.5. Энергии уровней в молекулах бензола и бутадиена.
Из рис.11.5 видно, что молекула бутадиена менее устойчива, чем молекула бензола, т.к. 4 p-электрона бутадиена занимают 2 связывающих орбитали, а 6 p-электронов бензола - 3 связывающих орбитали. Для бутадиена энергия делокализации составляет величину: 2(ЕО + 1.62b) + 2(ЕО + 0.62b) = 4ЕО + 4.48b; тогда как без сопряжения 4ЕО+4b.
11.5. Молекулы гетероциклических соединений. Лекция 14
Если в молекуле бензола один из атомов углерода заменить на атом азота, то мы получим новое циклическое соединение под названием пиридин. Чисто формально азот без затруднений встраивается в шестиатомный цикл - число p-электронов сохраняется, не изменяется и тип гибридизации атомных орбиталей, образующих остов молекулы пиридина. Вместе с тем, у азота остаётся пара неподелённых электронов.
11.5.1. Метод ВС.
Рассмотрим поведение шести p-электронов независимо от электронов, образующих s-связь. Спаривание p-электронов будет происходить аналогично схемам Кекуле и Дьюара для бензола. Однако, вследствие большей электроотрицательности азота по отношению к углероду, в пиридине p-электроны будут смещаться к атому азота. Следовательно, в дополнение к 5 ковалентным структурам необходимо учесть и возможные ионные структуры (см. рис.11.6).
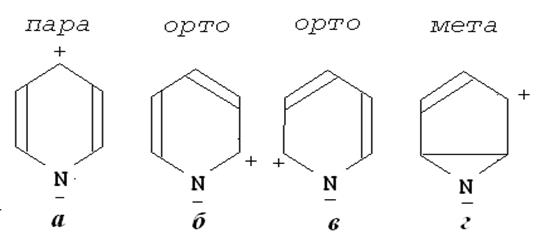
Рис.11.6. Ионные структуры в молекуле пиридина.
Помимо структур, представленных на рис.11.6, можно рассмотреть и другие, где заряд “+“ находится на азоте, а “-“ на углероде, а также “+“ и “-“ на атомах углерода. Однако такие структуры энергетически менее выгодны и поэтому заметного вклада в энергию резонанса не вносят. Структура г на рис.11.6 также не конкурентноспособна из-за наличия длинной связи. Резонанс между пятью ковалентными и тремя ионными структурами приводит к снижению энергии и переходу отрицательного заряда из орто- и пара-атомов углерода к атому азота (см. рис.11.6, а, б, в). Веса структур таковы:
2wКек + 3wДью + wа + wб + wв = 100 %. (11.13)
Теоретически рассчитать ab inito (лат. - от начала) энергию системы невозможно. Поэтому, как обычно, пользуются эмпирическими данными.
11.5.2. Метод МО.
Метод МО даёт более точную трактовку состояния системы и позволяет рассчитать распределение заряда по атомам молекулы. Используя эффективный одноэлектронный гамильтониан, рассчитывают энергии, а затем и коэффициенты (вклады) для различных МО. Для определения результирующего распределения заряда учитывают орбитали всех p-электронов (простирающихся на весь скелет молекулы). Распределение заряда находят для каждой орбитали в отдельности на каждом атоме и затем суммируют эти распределения по всем занятым орбиталям. Другими словами, для волной функции
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.