Полная делокализация pz-электронов приводит к значительному понижению энергии системы, а, следовательно, и к повышению устойчивости бензольного кольца. Существенный вклад в устойчивость кольца вносят также s-связи и тот факт, что валентные углы (120О) в точности отвечают тригональной гибридизации атомных орбиталей электронов углерода. Кроме того, повышает устойчивость и то, что в молекуле бензола целиком заполнены только связывающие молекулярные орбитали.
В случае циклобутадиена С4Н4 валентные углы составляют 900, у циклооктатетраена С8Н8 углы равны 1350. В таких соединениях происходит сильный изгиб валентных связей, что приводит к значительному понижению перекрывания электронных облаков. Поэтому потери энергии при изгибе s-связей не компенсируются выйгрышем энергии за счёт делокализации pz -электронов, что приводит к неустойчивости этих молекул (циклобутадиен вообще не получен).
11.2. Структуры Дьюара.
Помимо спаривания ближайших p-электронов по структуре Кекуле необходимо рассмотреть и другие возможные варианты спаривания, например, по диагонали шестиугольника молекулы бензола (структуры Дьюара). На рис.11.4 представлены такие квантово-механические структуры.
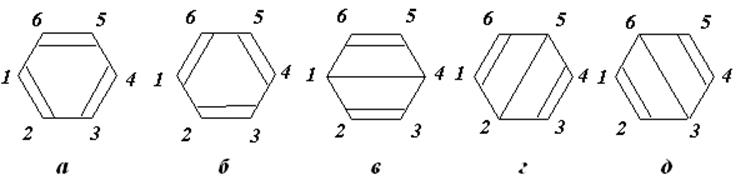
Рис.11.4. Структуры Кекуле (а, б) и Дьюара (в, г, д) для молекулы бензола.
Вследствие наличия “длинной связи” (в - 1-4, г - 2-5, д - 3-6) структуры Дьюара дают меньшую энергию связи, чем структуры Кекуле. Все пять структур должны быть учтены в полной волновой функции:
Y = c2(yа + yб) + c3(yв + yг + yд) (11.2)
В общем случае, при наличии 2n p-электронов существует 2n!/n!(n + 1)! независимых ковалентных структур. Для бензола 2n = 6 и структур получается 5 (для нафталина 2n = 10 - 42, для антрацена 2n = 14 - 429). Выражение для энергии одной структуры Кекуле можно записать, воспользовавшись формулой приближения полного электронного спаривания (см. ур. 9.9). Опуская члены, относящиеся к энергии атомов, рассмотрим только энергию структуры б с p-электронами:
ЕКек = С + А23 + А45 + А61 - 0.5(А12 + А34 + А56) (11.3)
Здесь слагаемое С - кулоновская энергия. Принято, что все обменные интегралы между несоседними атомами раны нулю. Поэтому члены
- 0.5(А13 + А14 + А15) опущены. Если все связи имеют одинаковую длину, то
ЕКек = С + 1.5А (11.4)
Для одной структуры Дьюара (например, в) получим:
Е = С + А23 + А56 - 0.5(А12 + А34 + А45 + А61) = С (11.5)
Т.к. А несколько меньше 2 эВ (1.6 эВ), то структура Дьюара должна быть примерно на 2.5 эВ менее устойчива структуры Кекуле
11.3. Вычисление весов по методу валентных связей. Случай бензола.
При применении метода ВС задача заключается в вычислении относительных весов каждой из различных выбранных структур. Записывается волновая функция в виде суммы (линейной комбинации) волновых функций каждой из структур со своим весом (коэффициентом):
Y = с1y1 + с2y2 + . . . скyк. (11.6)
Коэффициенты и энергия определяются из решения системы секулярных уравнений. Для бензола резонанс двух структур Кекуле даёт энергию:
Е1 = С + 2.4А. (11.7)
Т.к. согласно выражению 11.4 ЕКек = С + 1.5А, то энергия резонанса составляет 0.9А (примерно 1.5 эВ). Для трёх структур Дьюара:
Е2 = С + 2.0А . (11.8)
Т.о. две структуры Кекуле дают лучшее приближение к полной волновой функции, чем три структуры Дьюара. С учётом всех пяти структур:
Е3 = С + 2.6А . (11.9)
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.