Кафедра физической химии
Определение кинетических параметров ферментативного окисления глюкозы кислородом под действием глюкозооксидазы
Выполнили: А.Е. Арзамасцев
Р.А. Бредихин
Новосибирск, 2006
Если термодинамика ставит вопрос о теоретической осуществимости химической реакции, то химическая кинетика занимается исследованием особенностей и закономерностей тех превращений, которые возможно осуществить на практике. Химическая реакция может представлять собой самопроизвольный процесс с точки зрения термодинамики, но протекать с ничтожной скоростью. Как правило, причиной низкой скорости является высокий энергетический барьер, который необходимо преодолеть для запуска превращения. Так, например, алмаз существует в стандартных условиях, хотя термодинамически более стабилен графит. Поэтому для кинетики становится важным понятие скорости превращения вещества. Скорость химической реакции определяют как число актов превращения в единице объёма в единицу времени [1].
На скорость химической реакции можно воздействовать. Катализатор – вещество, которое, будучи добавлено в реакционную массу, сокращает время, необходимое для достижения равновесного состояния. Для уменьшения скорости реакции используют ингибиторы.
Следует отметить, что в физиологических условиях (pH≈6,5-7,0, T≈40°С) большинство реакций протекают с ничтожной скоростью. В организме их скорость должна быть намного выше. Для их осуществления необходимы ферменты. Ферменты представляют собой уникальные природные катализаторы. Главная их особенность – высокая специфичность по отношению к субстрату и высокая эффективность. Следовые концентрации ферментов способны ускорять реакции в сотни тысяч раз (вплоть до 108-1012) [2]. Такой результат объясняется взаимодействием фермента с субстратом с образованием фермент-субстратного комплекса, что приводит к значительному понижению энергии активации, а значит, к ускорению химической реакции.
Скорость ферментативной реакции зависит от многих параметров. Во-первых, от концентрации фермента и его активности (способности ускорять реакцию), во-вторых, от концентрации субстрата. Кроме того, значительное влияние оказывают состав буферной среды и pH. Например, для функционирования многих ферментов необходим кофермент (кофактор) в виде катиона некоторого металла (Mg2+, Ca2+ и др.). С ростом температуры скорость ферментативной реакции увеличивается, но при этом растёт и скорость дезактивации. Значит, существует температурный оптимум для ферментативной реакции.
Кинетика ферментативных реакций.
Первыми исследователями стали Леонор Михаэлис и Мод Ментен в 1913 году [3]. Они предложили способ определения скорости ферментативной реакции, введя следующие допущения:
1. Реакция образования фермент-субстратного комплекса обратима.
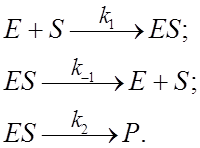
2. Фермент в активном состоянии связывает только 1 молекулу субстрата.
3. Фермент-субстратный комплекс необратимо превращается в продукт реакции
4.
Лимитирующей является стадия
образования продукта (k2<<k-1), т.е. ![]()
5.
Квазистационарные условия ![]()
6.
Принято считать, что ![]()
Тогда легко получить выражение для скорости ферментативной реакции:
![]()
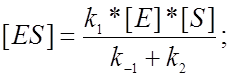
Константы скоростей можно выделить в виде одного постоянного множителя.
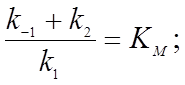
|
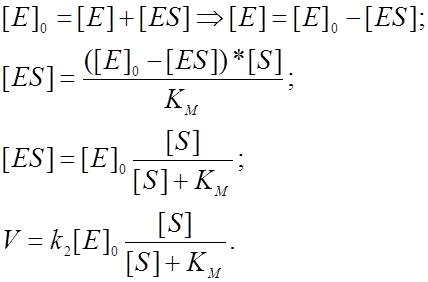
На практике используют разные способы определения константы Михаэлиса.
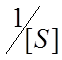 и
представляет собой прямую. Пересечение графика с осью ординат даёт
и
представляет собой прямую. Пересечение графика с осью ординат даёт 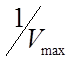 , а пересечение с осью абсцисс –
значение
, а пересечение с осью абсцисс –
значение 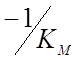 . При малых значениях
концентрации субстрата этот способ даёт большую погрешность, поэтому на
практике данный метод используют для приблизительных оценок. Уравнение,
таким образом, имеет следующий вид:
. При малых значениях
концентрации субстрата этот способ даёт большую погрешность, поэтому на
практике данный метод используют для приблизительных оценок. Уравнение,
таким образом, имеет следующий вид: 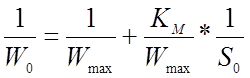 .
.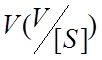 .
.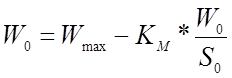 .
.Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.