Выполнили: Громов Н.В.
Михальченко О.С.
Проверил: к.х.н. Лузгин М.В.
Новосибирск, 2010 г.
Введение
Кондуктометрия (англ. conductivity — электропроводность) — совокупность электрохимических методов исследования веществ, основанных на измерении электропроводности растворов. Данный метод широко применяется для анализа количественного состава растворов электролитов в аналитической химии. Также данный метод нашел широкое применение и в физической химии для изучения различных процессов.
Цель работы
Определение константы скорости реакции омыления этилацетата.
Оборудование
Иономер «Анион 4100», термостат жидостный ТЖ-ТС-01, ПК.
Теоретическая часть.
В 1907 году Уокер на примере реакции омыления этилацетата показал возможность применения метода кондуктометрии в кинетике. Уравнение реакции выглядит следующим образом:
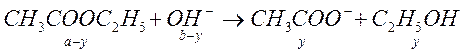 (1)
(1)
Здесь
aи b– начальные концентрации эфира и
щелочи соответственно, ![]() (глубина
реакции).
(глубина
реакции).
Данная реакция имеет второй порядок:
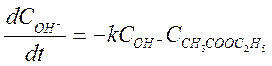 (2)
(2)
Или, с учетом написанного выше:
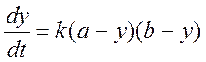 (3)
(3)
После интегрирования получим:
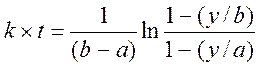 (4)
(4)
где
![]() –
текущая концентрация
–
текущая концентрация![]() .
.
Таким образом, для определения константы скорости нужно знать начальную концентрацию щелочи b, начальную концентрацию этилацетата aи зависимость от времени глубины реакции:
![]() (5)
(5)
Начальные концентрации щелочи и этилацетата известны, также они могут быть определены из полученных в ходе эксперимента значений χ.
В
нашей системе в произвольный момент времени электропроводность ![]() может
быть определена следующим образом:
может
быть определена следующим образом:
![]() (6)
(6)
Величина
![]() – это вклад в электропроводность
раствора, определяемый ионами Na+, концентрация которых постоянна
в ходе реакции, а также вклад в электропроводность от растворенного углекислого
газа. С учетом того, что
– это вклад в электропроводность
раствора, определяемый ионами Na+, концентрация которых постоянна
в ходе реакции, а также вклад в электропроводность от растворенного углекислого
газа. С учетом того, что![]() формулу
можно переписать в следующем виде:
формулу
можно переписать в следующем виде:
![]() (7)
(7)
Начальная электропроводность
раствора (![]() ) равна
) равна
![]() (8)
(8)
Если этилацетат взят в избытке, то по окончании реакции щелочь израсходуется полностью и электропроводность раствора будет равна
![]() (9)
(9)
Из выражений (7), (8), (9) получим:
![]()
![]()
Отсюда, разделив эти два равенства одно на другое, получаем простую формулу для расчета текущей концентрации щелочи:
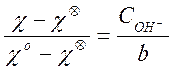 (10)
(10)
Если
этилацетат взят в недостатке или в эквивалентном количестве к щелочи, формула
также применима для расчёта текущей концентрации щелочи. Однако для её
использования необходимо в параллельном опыте определить величину ![]() .
Конечную электропроводность раствора после завершения реакции при недостатке
этилацетата и неполном расходовании щелочи обозначим как
.
Конечную электропроводность раствора после завершения реакции при недостатке
этилацетата и неполном расходовании щелочи обозначим как![]() .
Величина
.
Величина ![]() ,
как видно, не нужна для расчета текущей концентрации щелочи и константы
скорости реакции. Однако, она весьма полезна для определения начальной
концентрации этилацетата. Действительно, заменяя в формуле
,
как видно, не нужна для расчета текущей концентрации щелочи и константы
скорости реакции. Однако, она весьма полезна для определения начальной
концентрации этилацетата. Действительно, заменяя в формуле![]() на
на ![]() , получаем:
, получаем:
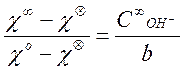 (11)
(11)
Поскольку
![]() имеется
возможность определить начальную концентрацию этилацетата из
кондуктометрических данных, что весьма удобно, если количество добавленного
этилацетата измерено только приблизительно. При этом
имеется
возможность определить начальную концентрацию этилацетата из
кондуктометрических данных, что весьма удобно, если количество добавленного
этилацетата измерено только приблизительно. При этом ![]() и
и ![]() измеряются в параллельных опытах
при одинаковой начальной концентрации щелочи, но при различной начальной
концентрации этилацетата.
измеряются в параллельных опытах
при одинаковой начальной концентрации щелочи, но при различной начальной
концентрации этилацетата.
Экспериментальная часть.
Три колбы на 50 мл заполнили раствором 0.021 М NaOH в воде и термостатировали их при 25º.
К раствору в колбе
№1 добавили избыток этилацетата (200 мкл), колбу закрыли, перемешали и оставили
в термостате на 2 ч. После
завершения реакции измерили величину ![]() , результаты занесены в таблицу
1:
, результаты занесены в таблицу
1:
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.