ИЗУЧЕНИЕ ЭЛЕКТРОННО-КОЛЕБАТЕЛЬНОГО СПЕКТРА ПОГЛОЩЕНИЯ МОЛЕКУЛЫ ЙОДА
Цель работы: Изучить закономерности электронно-колебательных спектров двухатомных молекул, определить характеристики электронно-колебательных переходов молекулы йода.
Приборы: Монохроматор УМ-2, ртутная лампа ДРШ-250, лампа накаливания, кювета с кристаллическим йодом, конденсор.
Теоретическое введение
Электронно-колебательные спектры поглощения или излучения молекул располагаются в видимой и ультрафиолетовой области и представляют собой совокупности полос. Полосы обычно имеют резкий край с одной стороны, называемый кантом полосы, и размытый – с другой. При регистрации такого спектра с помощью прибора с высокой разрешающей способностью обнаруживается колебательная структура электронной полосы, анализ которой позволяет определить ряд молекулярных параметров, характеризующих электронное и колебательное движения молекулы.
В данной работе исследуется спектр поглощения двухатомных молекул йода. Этот спектр находится в видимой области и представляет собой серию полос, сгущающихся по мере уменьшения длин волн.
Последовательное описание структуры электронно-колебательного спектра молекул дает квантовая механика. С квантово-механической точки зрения полная энергия молекулы в определенном стационарном состоянии выражается следующим образом:
![]() , (1)
, (1)
где ![]() -
энергия электронного движения молекулы (электронная энергия),
-
энергия электронного движения молекулы (электронная энергия), ![]() - энергия колебательного движения молекулы
(колебательная энергия),
- энергия колебательного движения молекулы
(колебательная энергия), ![]() - энергия вращательного
движения молекулы (вращательная энергия),
- энергия вращательного
движения молекулы (вращательная энергия), ![]() ,
, ![]() ,
, ![]() -
энергии, учитывающие взаимное влияние электронного и колебательного,
электронного и вращательного, колебательного и вращательного видов движения
молекулы, соответственно.
-
энергии, учитывающие взаимное влияние электронного и колебательного,
электронного и вращательного, колебательного и вращательного видов движения
молекулы, соответственно.
Электронная, колебательная и вращательная энергии квантованы. Для двухатомной молекулы правило квантования колебательной энергии в ангармоническом приближении имеет вид:
![]()
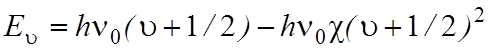 ,
(2)
,
(2)
где 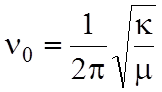 - собственная частота колебания
молекулы,
- собственная частота колебания
молекулы, ![]() -силовая
постоянная химической связи молекулы,
-силовая
постоянная химической связи молекулы, ![]() -ее
приведенная масса,
-ее
приведенная масса, ![]() = 0,1,2,…. –
колебательное квантовое число,
= 0,1,2,…. –
колебательное квантовое число, ![]() -
параметр ангармоничности колебания.
-
параметр ангармоничности колебания.
Как видно из
формулы (2), с увеличением квантового числа ![]() энергетическая
разность между колебательными уровнями уменьшается.
энергетическая
разность между колебательными уровнями уменьшается.
Квантование вращательной энергии двухатомной молекулы имеет вид:
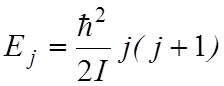 ,
(3)
,
(3)
где j = 0, 1, 2, 3…; – вращательное квантовое число, I – момент инерции молекулы.
При переходе из одного стационарного состояния в другое могут изменяться все составляющие части энергии молекулы энергия излучаемого или поглощаемого кванта света будет равна:
![]() , (4)
, (4)
где один и два штриха, как принято в спектроскопии, относятся к верхнему и нижнему состояниям, соответственно.
Опыт и теория
показывают, что ![]() . В случае перехода молекул из
одного электронного состояния в другое, т.е. в случае электронно-колебательных
переходов, не существует строгого правила отбора для колебательного квантового
числа
. В случае перехода молекул из
одного электронного состояния в другое, т.е. в случае электронно-колебательных
переходов, не существует строгого правила отбора для колебательного квантового
числа ![]() , и каждое колебательное состояние верхнего
электронного состояния может комбинировать с каждым колебательным состоянием
нижнего электронного состояния. Если учесть вращательные переходы, то получим,
что каждому электронно-колебательному переходу будет соответствовать полоса,
состоящая из большого числа близко расположенных линий.
, и каждое колебательное состояние верхнего
электронного состояния может комбинировать с каждым колебательным состоянием
нижнего электронного состояния. Если учесть вращательные переходы, то получим,
что каждому электронно-колебательному переходу будет соответствовать полоса,
состоящая из большого числа близко расположенных линий.
C учетом вышесказанного частота электронно-колебательного перехода в спектре поглощения (в пренебрежении вращательным движением) на основании формулы (4) определяется следующим образом:
![]()
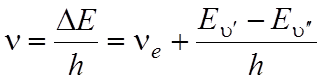 ,
(5)
,
(5)
где 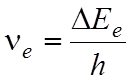 определяет
изменение электронной энергии при данном переходе и определяет нулевую линию
полосы. Нулевая линия каждой полосы соответствует переходу
определяет
изменение электронной энергии при данном переходе и определяет нулевую линию
полосы. Нулевая линия каждой полосы соответствует переходу ![]()
![]()
![]()
Используя (2) и (5), получим, что частоты электронно-колебательных переходов в поглощении могут быть вычислены по формуле:
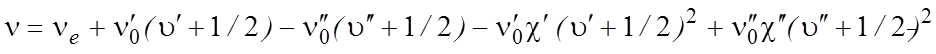 (6)
(6)
Здесь
![]() ,
, ![]() -
частоты собственных колебаний молекулы в возбужденном
-
частоты собственных колебаний молекулы в возбужденном ![]() и
основном
и
основном ![]() колебательных состояниях;
колебательных состояниях; ![]() ,
, ![]() -
параметры ангармоничности колебаний в соответствующих состояниях молекулы.
-
параметры ангармоничности колебаний в соответствующих состояниях молекулы.
При невысоких
температурах большая часть молекул находится на нижнем колебательном уровне
основного состояния ![]() . Поэтому при поглощении
соответствующих квантов практически имеются только переходы из нижнего
колебательного состояния
. Поэтому при поглощении
соответствующих квантов практически имеются только переходы из нижнего
колебательного состояния ![]() на различные
колебательные уровни верхнего электронного состояния
на различные
колебательные уровни верхнего электронного состояния ![]() (см.
рисунок 1). Если величина колебательного кванта в электронном состоянии
невелика или температура достаточно высока, то часть молекул находится в
возбужденном состоянии
(см.
рисунок 1). Если величина колебательного кванта в электронном состоянии
невелика или температура достаточно высока, то часть молекул находится в
возбужденном состоянии ![]() , и поэтому при поглощении могут
возникнуть переходы и из первого возбужденного колебательного состояния.
, и поэтому при поглощении могут
возникнуть переходы и из первого возбужденного колебательного состояния.
 |
При интерпретации экспериментальных спектров сведения о структуре электронно-колебательной полосы молекулы сводятся в таблицу, называемую схемой Деландра. Она имеет вид таблицы, в которую занесены значения частот (волновых чисел) электронно-колебательных компонент полосы.
Определив экспериментально частоты (волновые числа )
электронно-колебательных переходов в спектре поглощения и отнеся их к поперечной
серии в схеме Деландра при ![]() = 0, можно, пользуясь
формулой (6), определить характеристики молекулы
= 0, можно, пользуясь
формулой (6), определить характеристики молекулы ![]() , а
также
, а
также ![]() ,
, ![]() ,
, ![]() молекулы в возбужденном электронном
состоянии
молекулы в возбужденном электронном
состоянии ![]() . Кроме того можно вычислить энергию
диссоциации
. Кроме того можно вычислить энергию
диссоциации ![]() молекулы в верхнем состоянии, т.е. найти
максимальную колебательную энергию молекулы в данном состоянии.
молекулы в верхнем состоянии, т.е. найти
максимальную колебательную энергию молекулы в данном состоянии.
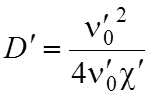 . (7)
. (7)
|
|
0 |
1 |
2 |
3 |
4 |
…. |
|
0 |
||||||
|
2 |
||||||
|
3 |
||||||
|
4 |
||||||
|
…. |
Порядок выполнения работы
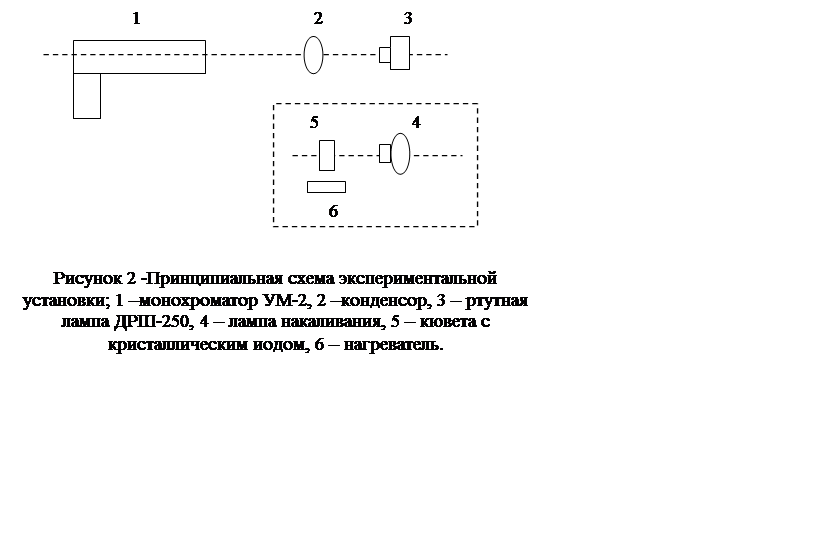
1. Изучить оптическую схему и принцип работы установки.
2. Установить ртутную лампу ДРШ-250 перед монохроматором, включить ее и провести юстировку установки.
3. Пользуясь атласом спектральных линий ртути, провести градуировку монохроматора, построить градуировочный график.
4. Установить
перед монохроматором лампу накаливания и кювету с кристаллическим йодом,
включить подогрев кюветы. Получить отчетливый спектр поглощения молекул йода.![]()
5. Используя
градуировочный график, найти в спектре поглощения йода полосу с длиной волны ![]() = 548,3 нм с квантовым числом
= 548,3 нм с квантовым числом ![]() =35.
=35.
6. Определить длины волн 5-7 полос поглощения йода,
находящихся в окрестности ![]() и занести
соответствующие им значения частот в таблицу Деландра
и занести
соответствующие им значения частот в таблицу Деландра
7. На основании полученных данных рассчитать значения ![]() ,
, ![]() ,
, ![]() ,
,![]() и определить энергию
диссоциации молекулы йода в возбужденном состоянии.
и определить энергию
диссоциации молекулы йода в возбужденном состоянии.
 |
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.