Уравнение (3.1), как и уравнение Нернста — Планка (2.1), отражает состав тока по каждому сорту ионов i: ток «миграции» под действием полярных кулоновских сил и ток диффузии под действием электронейтральных осмотических молекулярных сил. В неподвижной жидкости ток конвекции отсутствует. Уравнение (3.2) отражает закон сохранения зарядов ионов как в диссоциированном, так и в связанном состояниях. Связь между степенью диссоциации и концентрацией электролита считается известной. Для упрощения выкладок расчет первоначально ведется в приближении полной диссоциации. Уравнение (3.2) представляет запись теоремы Остроградского — Гаусса.
Ввиду особой простоты подсистемы (3.2) в составе всей системы (3.1) — (3.3) целесообразно начать решение (в виде первого этапа) именно с этой подсистемы. Для единственности решения (3.2) необходимы три краевых условия. Пусть ионы сортов 1 и 2 являются активными переносчиками тока, а ионы сорта 3 пассивны в этом отношении. Отсюда следуют два краевых условия
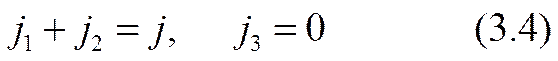
Необходимо иметь еще одно независимое соотношение между ними. Вид этого соотношения определяется из корпускулярных представлений законами сохранения одновременно как электрических зарядов ионов, так и реагирующих в них атомов (или групп атомов) вещества, а также условиями обратимости приэлектродных реакций — вещества не выделяются из электродов и не выпадают в осадок. Эти реакции проще всего представить схематически (как это сделано, например, в [3.17, стр. 783]) так:
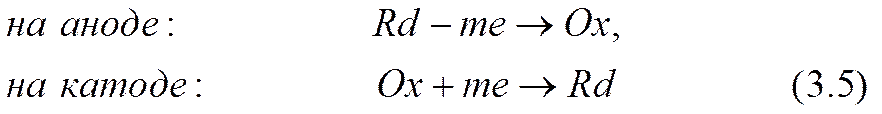
Здесь обозначено: Ox, Rd, m — соответственно ион окисленной активной формы, ион восстановленной формы, число электронов е, перешедших с катода в раствор или из раствора на анод из расчета на один ион.
Пассивный ион тернарных окислительно-восстановительных систем может быть как положительным (например, ион К + в водных растворах I2 в KI), так и отрицательным (например, ионы С1- в смеси водных растворов FeCl2 и FeCl3, точнее, Fe3Cl6 + Fe2Cl6).
В качестве известных примеров приэлектродных реакций по схеме (3.5) можно привести реакции на платиновых электродах в ячейке с раствором молекулярного иода I2 в водном растворе йодистого калия KI (z3 > 0) или со смесью водных растворов FeCl2 и FeCl3 (z3<0):
на аноде:
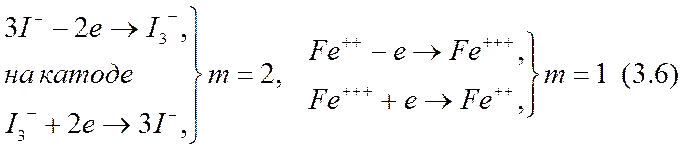
В случае положительного пассивного иона (z3> 0) ионы активных форм отрицательны. Тогда переход из окисленной формы (i = 1) на катоде или восстановленной формы (i = 2) на аноде соответственно в восстановленную или окисленную формы происходит либо, во-первых, только за счет увеличения абсолютного значения валентности иона на т единиц, как в формуле (3.5):
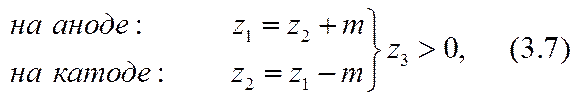
например при т = 1
![]()
либо, во-вторых, этот переход происходит еще и за счет р-кратного объединения ионов
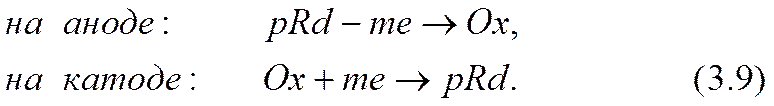
Здесь т и р суть целые положительные числа.
Из закона сохранения зарядов в приэлектродных реакциях вытекает следующее соотношение между этими числами:
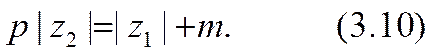
Например, для иона иода в (3.6) получается
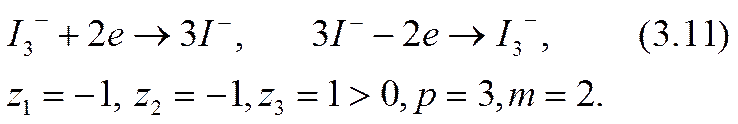
На основании этих и подобных им примеров можно убедиться, что закон сохранения ионообразующих атомов и атомных групп в их диссоциированном и ассоциированном состояниях в приэлектродных реакциях (3.7), (3.9) с учетом (3.10) следует записывать так:
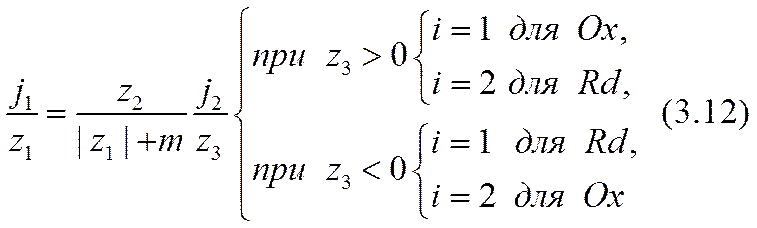
и далее:
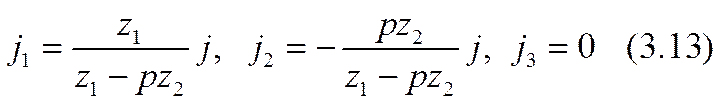
Таким образом, задача первого этапа нахождения плотностей парциальных токов по уравнению (3.2) разрешена сполна. Соотношения (3.5), (3.12) составляют краевые условия, а (3.13) — решение подсистемы (3.2) в этих краевых условиях. В перечисленных здесь выражениях отражен тот важный универсальный факт, что направления токов обеих активных ионных компонент тернарного электролита непременно взаимно противоположны, несмотря на то, что они имеют одинаковые знаки зарядов. Одна из них осуществляет как миграционный, так и диффузионный однонаправленные токи (как активная компонента в бинарных системах). Другая осуществляет преимущественный диффузионный ток, текущий против слабого миграционного тока; такое явление в бинарных системах не встречается. Третья — пассивная компонента (так же, как и пассивная компонента в бинарных системах) тока не переносит и стоит макроскопически неподвижно. В дальнейшем для определенности предположено, что пассивная компонента отрицательна:
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.