2.2. Теоретические основы процессов абсорбции и десорбции. Аппаратурное оформление процессов абсорбции и десорбции
2.2.1. Абсорбция
Абсорбция – это процесс поглощения компонента газовой смеси (абсорбтива) жидким поглотителем (абсорбентом), при этом абсорбент химически не взаимодействует с абсорбтивом.
Абсорбционные процессы широко распространены в химической промышленности – это поглощение ядовитых, агрессивных или редких газов из газовых смесей. Растворимость газов в жидкости увеличивается при увеличении давления в системе и снижении температуры.
Трудность расчета конкретного процесса состоит в том, что абгазы являются сложной смесью, состоящей из множества компонентов, состав которых не является постоянным, а изменяется в зависимости от условий ведения синтеза ЭТС-40. Поэтому в данной работе процесс абсорбции рассчитывали как процесс поглощения хлористого водорода из смеси с воздухом /10 - 18/, т.к. концентрации остальных компонентов незначительны по сравнению с основными. Механизм переноса массы сводится к молекулярной и конвективной диффузии. При молекулярной диффузии, происходящей в неподвижной фазе и ламинарном потоке, перенос массы характеризуется коэффициентом D, который рассчитывается для газа по уравнению (2.1) и для жидкости по уравнению (2.2):
Dг = 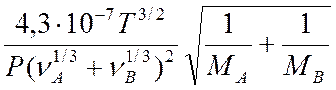 , (2.1)
, (2.1)
DЖ = 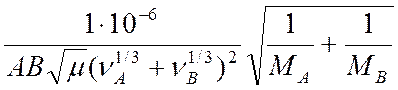 , (2.2)
, (2.2)
Закон Генри:
Р* = ЕHCl XHCl или X*HCl = Р*HCl / E. (2.3)
Числовое значение константы Генри для данного газа зависят от природы растворителя и газа и от температуры, но не зависит от общего давления в системе:
 , (2.4)
, (2.4)
где МА и МВ –
молекулярные массы компонентов, кг/кмоль; Р – абсолютное давление в системе. Па;
![]() – относительная массовая доля компонента в
жидкости, кг А/кг В; νА и νВ – мольные объемы паров
компонентов А и В, м3/кмоль, μ – коэффициент динамической вязкости
растворителя, Па с /6, 15/.
– относительная массовая доля компонента в
жидкости, кг А/кг В; νА и νВ – мольные объемы паров
компонентов А и В, м3/кмоль, μ – коэффициент динамической вязкости
растворителя, Па с /6, 15/.
При малых концентрациях компонента в смеси закон Генри примет вид:
Y* = E X/f0, (2.5)
где f0 – фугитивность или летучесть поглощаемого компонента, мм рт.ст.
Построение рабочей линии для прямоточного процесса абсорбции ведут на основе технологических параметров процесса и экспериментальных данных.
Уравнение рабочей линии:
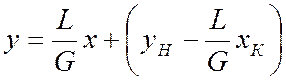 , (2.6)
, (2.6)
где L и G – расходы жидкости и газа, соответственно, кг/с; уН – начальная концентрация хлористого водорода в газовой смеси, масс. доли; хК – конечная концентрация хлористого водорода в жидкости, масс. доли.
Положение рабочей линии для прямоточного абсорбера представлено на рис. 1.
|
|
|
Рис. 2.1. Схема движения потоков. Положение рабочей линии для противоточной абсорбции
Из уравнения материального баланса определяется количество вещества, переходящее из одной фазы в другую и концентрацию газовой фазы на выходе из аппарата.
Уравнение материального баланса:
G (yH – yK) = L (xK - xH). (2.7)
Процесс абсорбции идет с выделением теплоты растворения. Уравнение теплового баланса:
tK = qд (xK - xH)/c + tH, (2.8)
где qд – дифференциальный тепловой эффект абсорбции, кДж/кг; с – теплоемкость абсорбента, кДж/(кг К). Для проведения изотерсического процесса абсорбции охлаждение абсорбера производят охлаждающей оборотной водой, расход которой определяют из уравнения (2.9):
GОХЛ.ВОДЫ = М qд/(tВОДЫ К - tВОДЫ Н), (2.9)
где GОХЛ.ВОДЫ – расход охлаждающей воды, кг/с; М – количество вещества, перешедшее из газа в жидкость, определяется из уравнения материального баланса, кг/с; tВОДЫ К и tВОДЫ Н – конечная и начальная температура охлаждающей воды, 0С.
Скорость процесса абсорбции характеризуется уравнением массопередачи:
М = Ку F ΔуСР или М = Кх F ΔхСР, (2.10)
где ΔуСР и ΔхСР – средняя движущая сила, выраженная через концентрации в газовой или жидкой фазы, масс. оли; F – поверхность контакта фаз, м2.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.