Для идеальных растворов справедливы уравнения Рауля и Генри. Графическое изображение закона Рауля дает рис. 3. Согласно уравнению Рауля:
pi = Pi·x'i, (2)
где рi — парциальное давление компонента;
х¢i — его молярная доля в жидкой фазе;
Pi — упругость пара чистого компонента при заданной температуре.
По закону Генри растворимость газов и паров в жидкости при постоянной температуре прямо пропорциональна давлению газа (пара) над раствором. Математически этот закон может быть записан так:
x'i = K¢i·pi, (3)
где х¢i — концентрация компонента в молярных долях в жидкости;
К¢i — константа;
pi — парциальное давление паров рассматриваемого компонента.
Это уравнение может быть записано и так:
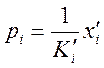 или
или ![]() (4)
(4)
Из сопоставления уравнений (2) и (4) видно, что для идеального раствора Ki = Pi т. е. константа Генри Ki совпадает с давлением пара чистого компонента при данной температуре.
Уравнения Рауля и Генри применимы ко многим реальным системам и могут быть использованы в расчетах с достаточной точностью. В частности, они применяются для расчетов ректификации смеси углеводородов в нефтяной и коксохимической промышленности.
Наряду с законами Рауля и Генри в дальнейшем будем пользоваться также и законом Дальтона. Согласно закону Дальтона общее давление газовой (паровой) смеси равно сумме парциальных давлений компонентов:
Р = p1 + p2 + p3 +…+ pn (5)
Одним из важных выводов закона Дальтона является положение о пропорциональности парциальных давлений компонентов идеальной газовой (паровой) смеси и их молярных долей в смеси:
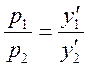
где y¢1 и у¢2 — молярные доли компонентов в смеси.
Отсюда следует:
 ;
; 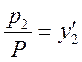
Эти соотношения, справедливые для идеальных газов (паров), позволяют находить состав газа (пара), если известны парциальные давления компонентов. Так как согласно уравнению Рауля pi = Pi·x'i то из предыдущего уравнения следует:
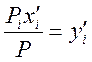
а следовательно,
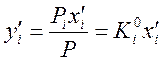 (6)
(6)
где  - константа равновесия;
- константа равновесия;
Pi — давление чистого компонента при заданной температуре;
Р — общее давление паров смеси при той же температуре.
Это уравнение позволяет находить для идеальных систем концентрацию компонента i в паровой фазе, если известна его концентрация в жидкой фазе.
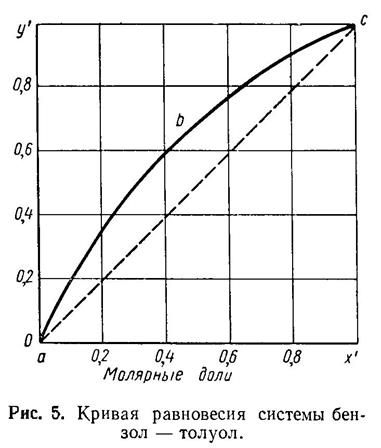
Используя законы Рауля и Дальтона, можно найти равновесные составы жидкой и паровой фаз для идеальных бинарных систем. Для примера рассмотрим систему бензол - толуол.
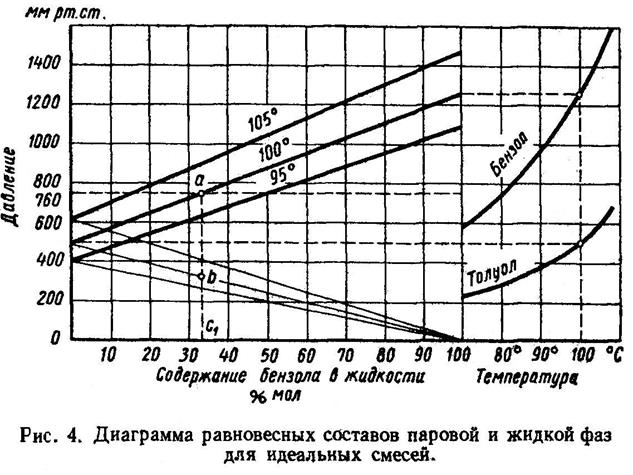 |
 Для идеальных смесей содержание компонентов в парах по
закону Рауля выражается как:
Для идеальных смесей содержание компонентов в парах по
закону Рауля выражается как:
![]() и
и 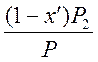
где x¢ - содержание н. к. в молярных долях;
P1 и P2 - упругость пара чистых компонентов при данной температуре;
P - общее давление в системе.
Поэтому:
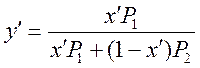 (7)
(7)
Неидеальные системы с полной взаимной растворимостью
Взаимно растворимые неидеальные бинарные системы разделяются на две группы:
а) жидкие смеси, отклоняющиеся от закона Рауля, но не образующие смеси с постоянной температурой кипения;
б) жидкие смеси, отклоняющиеся от закона Рауля и образующие смеси с минимальной или максимальной температурой кипения. Эти смеси носят название азеотропных или нераздельно кипящих смесей.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.