Так, например, при ректификации водного раствора метилового спирта имеется двухфазная, двухкомпонентная система.
Основным законом, управляющим системами, находящимися в равновесии, является правило фаз, выведенное Д. В. Гиббсом. Системы, рассматриваемые в науке о ректификации, относятся к таким, на которые из внешних факторов воздействуют только температура и давление. Для таких систем правило фаз может быть сформулировано так:
«Число степеней свободы С равно числу независимых компонентов К минус число фаз Ф плюс 2».
С = К - Ф + 2 (1)
Числом степеней свободы называют число условий (температура, давление, концентрация), которые нужно произвольно принять, чтобы определить значение всех остальных условий (параметров). Так, для упомянутой выше системы метанол - вода число фаз равно 2, число компонентов - 2. Отсюда число степеней свободы также равно 2. Следовательно, если за произвольно выбранные параметры (условия) взять температуру и концентрацию, то давление в системе будет иметь некоторое определенное значение, которое уже не может быть выбрано произвольно. За произвольно выбираемые параметры можно взять концентрацию метанола (или воды) и давление, тогда температура системы определится.
Классификация бинарных систем. Идеальные системы
Бинарные системы принято разделять на три основные группы: жидкости, смешивающиеся одна с другой при любых соотношениях; жидкости, практически не растворимые одна в другой; жидкости, смешивающиеся частично, т. е. не при всех соотношениях. К первой группе систем относятся системы, имеющие большое техническое значение.
При рассмотрении жидкостей, смешивающихся при любых соотношениях компонентов, остановимся сначала на идеальных растворах.
Идеальный раствор — понятие гипотетическое. Однако к свойствам идеального раствора приближаются многие реальные растворы, ректификация которых производится в промышленности. Поэтому законы, которым подчиняются идеальные растворы, играют большую роль в расчетах ректификационных процессов.
Идеальным раствором называют такой раствор, в котором линия, выражающая зависимость общего давления Р при постоянной температуре от состава жидкой фазы с, является прямой.
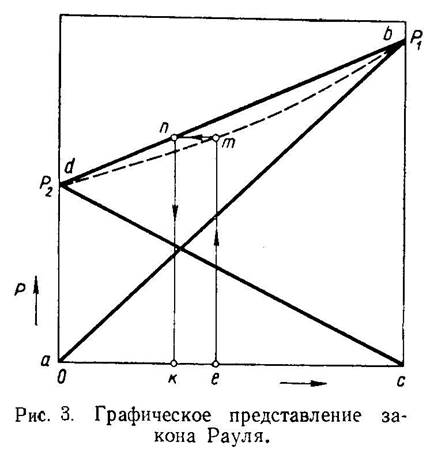
Диаграмма Р = f (с) при t = const выражает зависимость общего давления Р от концентрации компонентов с; для идеальных растворов она представлена на рис. 3.
 На оси абсцисс графика откладывается содержание н. к.
в молярных процентах; на оси ординат — давление в мм рт. cт. или кг/см2.
На оси абсцисс графика откладывается содержание н. к.
в молярных процентах; на оси ординат — давление в мм рт. cт. или кг/см2.
Линия ab показывает изменение парциального давления н. к. по мере увеличения его концентрации в смеси. Линия cd показывает то же для в. к. Изменение общего давления изображается линией db.
Таким образом, величина общего давления паров для идеальных растворов изменяется по прямой линии, соединяющей точки d и b. Эти точки на графике отвечают давлению паров чистых компонентов при данной температуре.
Если изобразить общее давление пара смеси Р как функцию состава парообразной фазы, то для идеальных растворов можно получить кривую (гиперболу), показанную на рис. 3 пунктиром. Уравнение этой гиперболы будет иметь следующий вид:
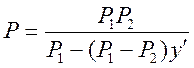
где P1 и Р2 — давление чистых компонентов при данной температуре,
у' — содержание н. к. в паровой фазе в молярных долях.
Для того чтобы найти суммарное давление в системе, если задан состав его паров, необходимо отложить этот состав е на оси абсцисс и восстановить перпендикуляр до пересечения с пунктирной линией в точке т. Соответствующий состав жидкой фазы будет найден, если провести из точки т горизонталь до пересечения с линией db в точке п. Опустив из точки п перпендикуляр, находят в точке k состав равновесной жидкой фазы.
Если же задан состав жидкой фазы, то, следуя по линиям kn, пт, те, найдем в точке е состав равновесной паровой фазы.
Принимают, что компоненты идеального раствора не образуют между собой соединений и между молекулами компонентов не происходит каких-либо взаимодействий. Поэтому при смешении компонентов не происходит изменения объема, и смешение не сопровождается выделением или поглощением тепла.
К идеальным системам приближаются следующие реальные системы: бензол - толуол, н-гексан - н-гептан, метиловый спирт - этиловый спирт, метан - этан, азот - окись углерода и др.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.