

1. Влияние времени на скорость реакции. Уравнение Арениуса.
Империческое правило Ван Гоффа говорит: при повышении температуры на 10 град. Скорость химической реакции возрастает в 2….4 раза.
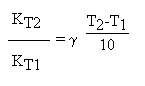
где g=2....4 - температурный коэффициент
Арениус показал почему реакции протекают не со скоростью взрыва, а подчиняются правилу Ван Гоффа.
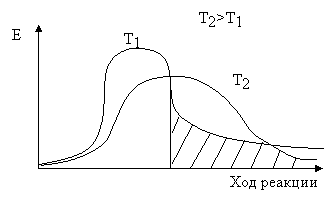
В химическое взаимодействие вступают только те молекулы, энергия которых больше или равна энергии активации.
 |
|||
|
|||
K=A*e–Ea/RT
K – константа скорости
A – предэкспонентационный множитель
ln KT2/ KT1=(Ea/R)(1/T1-1/T2)
Основные положения теории Арениуса.
Чтобы произошло химическое взаимодействие, надо:
1) столкновение молекул
2) энергия молекул должна быть больше или равна энергии активации
3) столкновение должно приходится на функциональную группу.
Недостатки теории.
1) Реальная скорость часто оказывается ниже, чем рассчитанная по теореме Арениуса
2) Она не объясняет явление катализа.
Теория активированного состояния или переходного комплекса.
H2+J2=2HJ
В ходе химической реакции взаимодействия продукты образуются не сразу после столкновения исходных веществ, а сначала образуется промежуточный комплекс. Это реальная молекула, в которой старые связи ещё не совсем разорвались, а новые связи не совсем образованы.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.