1. Основные законы химии.
1) Закон кратных отношений.
если два элемента образуют несколько соединений, то весовые количества одного элемента (кислород), который соединен с одним и тем же количеством другого элемента относятся между собой, как небольшие целые числа.
H2O
2:1 Закон справедлив для соединений с постоянным составом.
H2O2
Для соединений с переменным составом закон не выполняется. ZnO1-x
2) Закон Авогадро.
В равных объемах различных газов и паров при нормальных условиях содержится одинаковое число молекул.
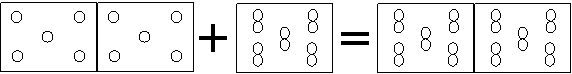
H2 + O2 = 2H2O
1. 1 моль любого газа или пара при н.у. содержит 6,02*1023 структурных единиц.
н.у. всегда задаются 273 град. К
p=105Па
2. 1 моль любого газа или пара при н.у. занимает объем 22,4л.
3. Отношение масс равных объемов различных газов равно отношению их молярных масс и называется относительной плотностью первого газа по второму.
m1/m2=M1/M2=D
3) Закон эквивалентов
Все вещества реагируют друг с другом в количествах, равных или пропорциональных их химическим эквивалентам.
Химическим эквивалентом называется такое весовое количесвто, которое без остатка взаимодействует с 1г. водорода или же вытесняет такое количество водорода из кислоты.
m1/m2=Э1/Э2
Для расчета эквивалента элемента надо его атомную массу разделить на его валентность.
Определение эквивалента сложных веществ.
1. Экислоты=Mrкислоты/основность
4) Расчет эквивалентов оснований.
Эоснования=Mrоснования/кислотность(количество ОН)
5) Расчет эквивалентов солей и окидов.
Эсолей=Mrсоли/оксида/число атомов металла*валентность
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.