1. Свободная энергия Гиббса, как критерий самопроизвольного течения процесса.
Энтрапия является критерием самопроизвольного течения процесса только в изолированных системах. На практике надо знать критерии, описывающие реальные процессы.
Рассмотрим изотермический процесс в закрытой системе.
|
Обратимый процесс |
Необратимый процесс |
|
DS=Qобр./T p=const Qp=DH DH-TDS=0 DG=0 DG=DH-TDS |
DS=Qнеобр./T p=const DH-TDS<0 DG<0 |
Таким образом в закрытой системе все самопроизвольно протекающие процессы идут с уменьшением энергии Гиббса.
Условия равновесия DG=0
Условия самопроизвольного течения реакции DG<0
Все системы самопроизвольно стремятся к равновесию.
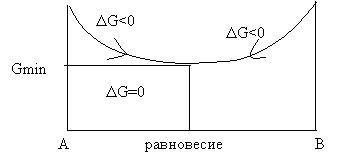 |
Изменение энергии Гиббса – движущая сила процесса.
HF*
Физический смысл изменения энергии Гиббса: -DG=Amax, максимально полезная работа, которая совершает система.
Все самопроизвольно протекающие процессы стремятся понизить запас своей энергии, то есть интальпия характеризует стремление к укрупнению частиц, образованию более крупных молекул.
Энтрапия – стремление системы к образованию более мелких частиц.
DG – равнодействующая двух противоположных процессов. Для химической реакции:
DG0=ånjDG0обр.прод.-åniDG0обр.исх.в-в
2. Закон Авогадро. Следствие закона Авогадро.
В равных объемах различных газов и паров при нормальных условиях содержится одинаковое число молекул.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.