При распаде активированного комплекса образуются продукты реакции. Т.о. энергия активации – это энергия, которая затрачивается на образование активного комплекса.
2. Электрохимическая коррозия.
Коррозия – самопроизвольное разрушение металла под действием окружающей среды.
Различают:
1) химическую коррозию (металлы в токонепроводящих средах)
2) электрохимическая коррозия (металлы в токопроводящих средах)
3)
 биологическая коррозия
(разрушение металлов под действием микроорганизмов, использующих металл в
качестве питания)
биологическая коррозия
(разрушение металлов под действием микроорганизмов, использующих металл в
качестве питания)
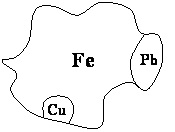
j0Fe2+/Fe0= -0,44B
j0Cu2+/Cu0= 0,337B
В местах соединения двух разнородных металлов возникает контактная разность потенциалов, анодом является более электроотрицательный металл.
A: Fe0-2e=Fe2+
Электроны переходят на металл с более положительным потенциалом. До тех пор, пока потенциалы не будут равны.
|
Влажный воздух: Fe2++2OH-®Fe(OH)2 ® ржавчина
Вода: К: 2H2O+2e=H2+2OH-
Кислота: K: 2H++2e=H2
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.