 ОДНИМ из важнейших вопросов, na который мы стремились ответить, был вопрос о том, как экспрес-сируются различные гены HBV. Нами было обнаружено, что трансгенные мыши, несущие целый геном HBV или его часть, могут
служить мощным инструментом для изучения экспрессии вирусных генов в нормальных тканях.
Используя таких животных, К. Пурсел в нашей лаборатории пыталась выяснить,
почему HBV
заражает
преимущественно определенных хозяев и определенные типы тканей. Она показала,
что ген S экспрессируется на
очень высоком уровне только в клетках печени и под влиянием стероидных гормонов.
Эти данные
объяснили тот факт, что риск ге-патомы, хронической инфекции HBV и поражения печени
для мужчин боль ше, чем для женщин, у которых уровень стероидных гормонов ниже.
ОДНИМ из важнейших вопросов, na который мы стремились ответить, был вопрос о том, как экспрес-сируются различные гены HBV. Нами было обнаружено, что трансгенные мыши, несущие целый геном HBV или его часть, могут
служить мощным инструментом для изучения экспрессии вирусных генов в нормальных тканях.
Используя таких животных, К. Пурсел в нашей лаборатории пыталась выяснить,
почему HBV
заражает
преимущественно определенных хозяев и определенные типы тканей. Она показала,
что ген S экспрессируется на
очень высоком уровне только в клетках печени и под влиянием стероидных гормонов.
Эти данные
объяснили тот факт, что риск ге-патомы, хронической инфекции HBV и поражения печени
для мужчин боль ше, чем для женщин, у которых уровень стероидных гормонов ниже.
У трансгенных мышей некоторых линий репликативные формы вирусной ДНК присутствовали не только в печени, но также в почках и сердце. Это аналогично сродству HBV к различным тканям у человека: хотя он чаще всего поражает печень, но вирусная ДНК и белки также обнаруживаются в почках, селезенке, поджелудочной железе, коже, костном мозге и циркулирующих клетках крови. Клетки крови могут быть первыми мишенями при инфекции HBV. Возможно также заражение печени после трансплантации других зараженных тканей. Заражение определенных лейкоцитов может играть прямую роль в некоторых болезнях, таких, как апласти-ческая анемия и полиартрит, а также вести к развитию СПИДа и связанных с ним заболеваний.
Некоторые представления о HBV сложились на основании изучения сходных вирусов — гепаднавирусов, которые вызывают у животных заболевания, подобные гепатиту. Известны гепаднавирусы, заражающие лесных сурков, бурундуков, пекинских уток, белок и цапель. По внешнему виду вирусных частиц эти вирусы очень похожи на HBV. Геном у них представлен кольцевой частично од-ноцепочечной ДНК, и организация его такая же, как у HBV.
Репродукция гепаднавирусов происходит необычным образом. У большинства ДНК-содержащих вирусов копирование генома осуществляется ферментами, называемыми по-лимеразами; при этом исходные цепи ДНК являются матрицами для синтеза комплементарных цепей. А у гепаднавирусов репликация идет через промежуточное звено — синтез РНК. Этот механизм был обнаружен в 1982 г. Дж. Саммерс и У. Мейсоном из Онкологического центра Фокс Чейз в Филадельфии, изучавшими ге-паднавирус пекинских уток.
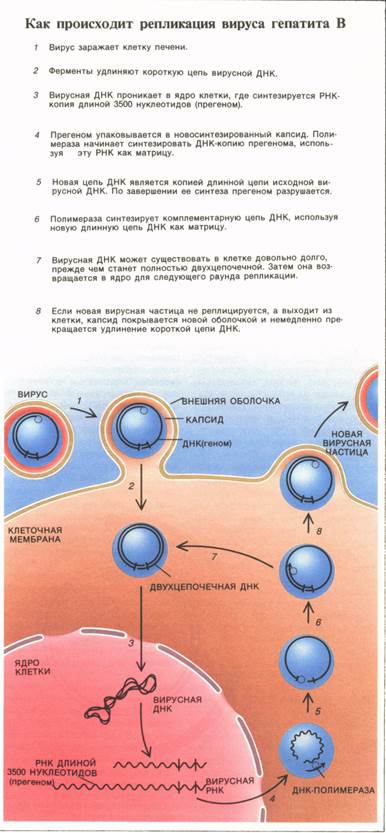
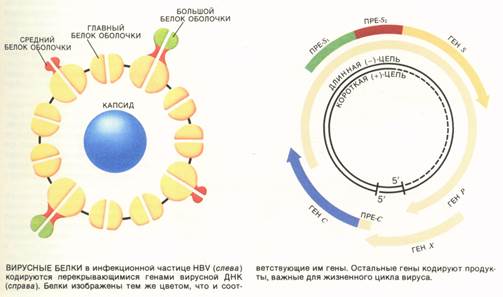 Оказалось, что происходит следующее.
После того как вирусная частица проникла
в клетку, ее геном попадает в ядро. Там
клеточная ДНК-зависимая
РНК-полимераза синтезирует РНК
размером 3500 нуклеотидов, которая
называется прегеномом. Далее прегеном
и вирусная ревертаза (ДНК-полимераза)
упаковываются во вновь сформированный
капсид и переносятся в цитоплазму,
где происходит обратная транскрипция прегенома — синтезируется новая «минус»-цепь ДНК. После
этого прегеном разрушается соответствующими
ферментами и начинается синтез
«плюс»-цепи ДНК, матрицей которой
служит «ми-нус»-цепь. Капсид и вирусная ДНК в конце концов заключается в
новую внешнюю оболочку, и готовая вирусная
частица покидает клетку. Рост «плюс»-цепи ДНК немедленно прекращается,
как только вирус выходит из клетки, поэтому длина этой цепи варьирует.
Оказалось, что происходит следующее.
После того как вирусная частица проникла
в клетку, ее геном попадает в ядро. Там
клеточная ДНК-зависимая
РНК-полимераза синтезирует РНК
размером 3500 нуклеотидов, которая
называется прегеномом. Далее прегеном
и вирусная ревертаза (ДНК-полимераза)
упаковываются во вновь сформированный
капсид и переносятся в цитоплазму,
где происходит обратная транскрипция прегенома — синтезируется новая «минус»-цепь ДНК. После
этого прегеном разрушается соответствующими
ферментами и начинается синтез
«плюс»-цепи ДНК, матрицей которой
служит «ми-нус»-цепь. Капсид и вирусная ДНК в конце концов заключается в
новую внешнюю оболочку, и готовая вирусная
частица покидает клетку. Рост «плюс»-цепи ДНК немедленно прекращается,
как только вирус выходит из клетки, поэтому длина этой цепи варьирует.
В целом удивительный механизм репликации гепаднавирусов больше
всего напоминает таковой ретровиру-сов (например, вируса, вызывающего СПИД), у которых геном представлен РНК, а ДНК является промежуточным звеном. Гепаднавирусы и ре-тровирусы имеют и другие общие свойства. И те и другие способны к хронической инфекции: они могут заражать клетки, не разрушая их. Структура и функции генов gag, pol и env ретровирусов аналогичны соответственно генам С, Р и 5 гепаднави-русов (gag кодирует белок капсида, pol — полимеразу, env — белок оболочки). Вирусы обоих семейств вызывают некоторые раковые заболевания.
Эпидемиологические исследования явно свидетельствуют, что хронической инфекции HBV или сходными ге-паднавирусами достаточно для злокачественного поражения печени. К примеру, у млекопитающих, хронически зараженных гепаднавирусами, часто бывают опухоли печени: более 80% зараженных земляных сурков приобретают первичный рак печени в течение двух лет. X. Поппер из Кор-неллского университета и Дж. Герин из Джорджтаунского университета с коллегами также показали, что у земляных сурков можно экспериментально вызвать гепатому путем инокуляции видоспецифичным вирусом гепатита.
Эти данные подтвердили онкоген-ные свойства HBV и исключили необходимость канцерогенных кофакторов для развития рака печени. Однако в заболевании человека могут играть роль и другие факторы, поскольку латентный период, предшествующий развитию гепатомы у людей, значительно длиннее, чем у земляных сурков, и опухоли часто возникают на фоне цирроза печени. Поэтому в генезисе гепатомы у человека, вероятно, имеют значение канцерогены из окружающей среды и обильное потребление алкоголя.
Но вопрос о том, как HBV индуцирует рак, по-прежнему остается открытым. С одной стороны, этот вирус может прямо вызывать развитие опухоли, с другой — возможна его косвенная роль: опухоли печени могут возникать из-за хронического воспаления, цирроза и регенерации клеток в пораженных тканях.
Многие опухолеродные вирусы несут онкогены — гены, которые впрямую трансформируют зараженные клетки. (Сходные онкогены имеются также в клетках, где они, по-видимому, участвуют в регуляции роста и развития.) Однако в геноме HBV, судя по всему, нет онкогена. Кроме того, долгий латентный период между заражением и появлением гепатомы вряд ли совместим с идеей о том, что ее вызывает вирусный онкоген. Тем не менее возможно, что белок-трансактиватор, кодируемый геном X HBV, действует на ранней стадии канцерогенеза.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.