Задача 1
Зависимость равновесных составов газа от
температуры в реакциях
восстановления железа из оксидов(FeO, Fe3O4)
газом СО представлена ни
рисунке. Определить температуру и состав газовой
фазы в точке К.Изменение стандартной энергии Гиббса,
Дж/моль,реакций образования оксидов железа и
углеродаописывается уравнениями:
ΔG°FeO=-269540+70,275T
ΔG°Fe3O4=-1126640+338,6T
ΔG°CO=-144280-85,69T
ΔG°CO2=-394970-0,54T
Решение:
(1) FeO+CO=Fe+CO2
(2) Fe3O4+CO=3FeO+CO2
ΔG°(1)=ΔGCO2-ΔGCO-ΔGFeO=-11150+14,9T
ΔG°(2)=3×ΔGFeO+ΔGCO2-ΔGCO-ΔGFe3O4=
=37330-42,6T
ΔG°(1)= ΔG°(2)
11150+14,9Т=37330-42,6Т Т=843К
ΔG°=1397,1Дж/моль ΔG°=-RTlnKp
lnKp=-0,199 Kp=0,82
Kp=pCO2/pCO Kp=(1-pCO)/pCO
1-pCO=0,82×pCO pCO=0,55атм.
XCO=55%мол. ХСО2=45%мол.
Задача 2
В стальные изложницы разливают сталь разных марок. Изложницу изнутри покрывают огнеупорной краской на основе оксида хрома. Углерод, содержащийся в расплавленной стали, может частично восстанавливать хром по реакции Сr2O3(тв) + 3[C] = 2[Cr] + 3CO.
Решение:
ΔG0Cr2O3 = - 1 109 080 + 247,08 × 1880 K = -644 569,6 Дж
ΔG0CO = -114 280 – 85,69 × 1880 K = -275 377,2 Дж
ΔG = 3×ΔG0CO - ΔG0Cr2O3 = 3×(-275 377,2) – (-644 569,6) = - 826 131,6 + 644 569,6 = -181 562 Дж
lnK= -ΔG/RT = 181 562/ 8,31×1880 = 11,62
K = 111 480,43
![]()
![]() =
= ![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() =
= ![]()
![]()
Задача 3
Алюминий и магний относятся к группе химически активных металлов. Широкое применение в настоящее время находят сплавы на их основе. Алюминий-магниевые сплавы готовят под покровным флюсом следующего состава (масс.%): CaF2 – 35, MgCl2 – 40 и KCl – 25. Магний, содержащийся в сплаве, может вступать в обменную реакцию с компонентами флюса(CaF2) + [Mg] = [Ca] + (MgF2).
Решение:
ΔG0CaF2 = - 1 218 430 + 162,142 × 1070 K = -1 044 938 ДжΔG0MgF2 = -1 111 290 + 161,306 × 1070 K = -938 692,6 ДжΔG = ΔG0MgF2- ΔG0CaF2 = - 938 692,6 – (-1 044 938) = 106 245,4 Дж
lnK= -ΔG/RT = -106 245,4/ 8,31×1070 = -11,95
K = 6,46×10-6
![]()
![]()
![]()
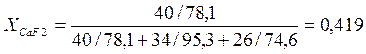
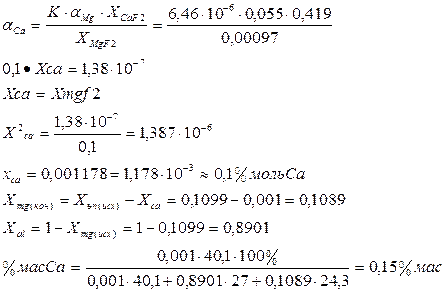
Задача 4
Продуктами восстановительной плавки ильменитовых концентратов являются высокотитанистые шлаки и чугун. Шлаки используются как сырье для получения титана: (FeO·TiO2) + [С] = [Fe] + (TiO2) + СО↑
Решение:
Вычислим изменение стандартной энергии Гиббса реакции при температуре 1880 К:
ΔG1880 = 178700 – 155,625·1880 = - 113875 Дж,
Рассчитаем значение константы равновесия реакции:
lnK = ![]() K
= 1464,14
K
= 1464,14
Запишем выражение константы равновесия реакции:
K = 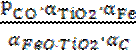
Определим мольную долю углерода:
Т.к., содержание углерода в чугуне составляет 3,8 % масс., то содержание железа будет равным 96,2 % масс.
XC = ![]()
Рассчитаем мольную долю железа:
XFe = ![]()
Вычислим коэффициент активности углерода:
lgγc = - 0,23 + 0,049·15,53 = 0,53
γc = 3,39 αС = XC· γc = 0,1553·3,39 = 0,53
Из выражения для константы равновесия реакции запишем выражение для αFeO·TiO2:
αFeO·TiO2 = ![]()
α = ![]()
α = ![]()
0,279 – 0,279a = 775,973a
X = ![]()
Задача 5
Углерод из передельного чугуна удаляется путём насыщения металла кислородом. Окисление углерода протекает по реакции:
![]()
Решение
∆G°р-ии = ∆G°CO - ∆G°FeO = (-114280 – 85,69 ∙1880) – (-255810 + 53,63 ∙1880) = -275377,2 + 154985,6 = -120391,6 Дж
lnK = - ∆G/RT = 120391,6 / 8,31∙1880 = 7,706 К = 2221,64
![]()
2Fe + O2 = 2FeO
0,02 mFeOmFeO = 0,0898 г
16∙2 2∙71,85 mFe = 100 – 0,0898 = 99,9102 г
![]()
γFeО
=0,7∙ехр(22000/1880)∙0,0007+1=60,21
αFeO = γ ∙Х = 60,21∙0,0007=0,042
ХFe=1-0,0007=0,9993 αFe = γ ∙Х = 1∙0,9993=0,9993
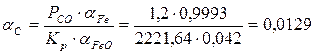
ХС = α / γ = 0,0129/0,8 =0,016 мол.%
мас.%
С = ![]() = 0,27.
= 0,27.
Задача 6
Один из способов снижения содержания магния во вторичном алюминии-это его смешивание с рафинировочным флюсом, содержащим фторид алюминия:
[Mg] + 2/3(AlF3) = 2/3[Al] + (MgF2)
Решение:
![]()
![]()
![]()
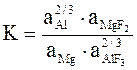
![]()
K = 39497,79
![]()
![]()
![]()
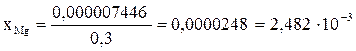
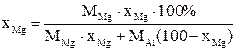
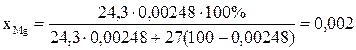
Задача 7
Процесс окислительного рафинирования меди от никеля требует насыщения её кислородом, при этом образуется оксид меди, которы й реагирует с никелем:
[Cu2O]+[Ni]=2[Cu]+(NiO)
Решение:
![]() G0=
G0=![]() GNiO0-
GNiO0-![]() GCu2O0=(-253500+95,1*1420)-(-14700+60*1420)=118458-(-61800)=-56658
Дж
GCu2O0=(-253500+95,1*1420)-(-14700+60*1420)=118458-(-61800)=-56658
Дж
Сu2O![]() 2Cu+1/2O2
2Cu+1/2O2
XCu2O=143,08
XCu=63,54
XO2=32, т.к ½ О2, то 16
Составляем пропорцию:
Исходя из данных нам известно, что О2=0,5масс.%
![]() в 100г
в 100г
XNiO=74,4
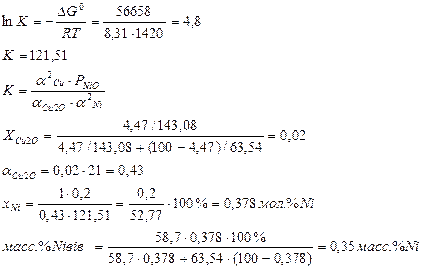
Задача 8
Раскисление (удаление кислорода) обычных сталей начинают с введения в жидкий металл марганца в виде ферромарганца. Удаление кислорода протекает по реакции[FeO]+[Mn]=[Fe]+MnO(тв)
Решение
ΔG°=-406200+87,9Т+255810-53,3Т=-150390+34,3Т
ΔG°1870=-86249Дж/моль
ΔG°=-RTlnKp lnКр=5, KP=256,6
![]()
![]()
![]()
![]()
![]()
![]()
![]()
Отсюда ХFeO=0,6%мол., или 0,3%мол. кислорода.
Задача 9
[Mn]+(FeO)=(MnO)+[Fe]
∆G![]() =-255810 + 53,63T
=-255810 + 53,63T
∆G![]() =-406200 + 87,9T
=-406200 + 87,9T
Молекулярные массы: Mn-54,94; Fe-55,85.
∆G![]() =∆G
=∆G![]() -∆G
-∆G![]() =(-406200+87,9*1870)-(-255810+53,63*1870)=-86305,1
Дж
=(-406200+87,9*1870)-(-255810+53,63*1870)=-86305,1
Дж
lnK=-![]() =
=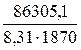 =5,554
=5,554
K=258,2685
![]()
![]()
![]()
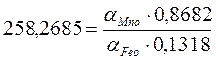
![]()
Задача 10
SiO2 +2C = [Si] + 2CO↑ T=1500K, PCO=0,2атм, γ=0,3
ΔGSiO2 =-906220+175.56T
ΔGCO =-114280-85.69T
ΔGреакции =157250.
lnK=- ΔGреакции/RT=-12.61. K=3.338*10-6
K= αSi*(Pco)2 αSi=3.338*10-6/0.04=8.325*10-5
α=X* γ
X=8.325*10-5*0.3 * 100% =0,0024975мол%
WSi = 0,0024975*28.08/ (0,0024975*28.08 + 99.9976*63.54) *100% = 0.01227масс%
Задача 11
Магний можно получать карбидотермическим восстановлением из расплава
MgCl2 - CaCl2 при температуре 1400 К:
(MgCl2) + CaC2(тв) = (CaCl2) + Mg(пар) + 2C
Решение
Вычислим изменение стандартной энергии Гиббса реакции при температуре 1400 К:
ΔG0 CaCl2 = - 797 800 + 145,85 • 1400 = - 593610 Дж,
ΔG0 MgCL2 = - 648 860 + 157,6 • 1400= - 428220 Дж,
ΔG0 CaC2 = - 60 190 + 26,25 • 1400 = - 96940 Дж.
Определим ΔG0 реакции:
ΔG0 р = (2 ΔG0С + ΔG0Mg + ΔG0 CaCl2 ) – ( - ΔG0 CaCl2 + ΔG0 MgCL2 )=
= - 593610 – ( - 96940 - 428220) = - 68450 Дж.
Рассчитаем значение константы равновесия реакции:
ln Kр = - ![]() = -
= - ![]() = 5,884
= 5,884
Kр = 359,24
Определим мольную долю χ MgCl2:
χ MgCl2 = ![]()
1,2 -1,2 χ MgCl2 =359,24 • χ MgCl2
1,2 = 360,4 χ MgCl2
χ MgCl2 = 3,33 • 10-3
χ MgCl2 = 0,33 % мол
%
мол MgCl2= ![]() = 0, 28% масс
= 0, 28% масс
Ответ: 0,28 % масс. MgCl2
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.