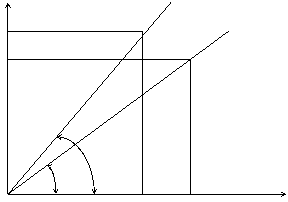
6. Знайти тангенс кута нахилу прямої до осі абсцис, який буде дорівнювати константі швидкості реакції при температурі t1. Для того, щоб знайти цю величину точніше, розмір графіка повинен бути не менше, ніж половина сторінки.
Vумов.
 с2 t2
с2 t2
с1 t1
v2 v1 К1 = v1 / c1 =tg a (див. рисунок)
a1 a2
С умов Na2S2O3
7. Провести ті ж досліди при температурі, на 10о вище кімнатної (t2). Для цього приготувати п¢ять пробірок з розчинами натрій тіосульфату і води (див. таблицю) та п¢ять пробірок з 3 мл розчину сульфатної кислоти. Помістити пробірки з розчинами в нагріту до вказаної температури водяну баню, витримати в ній не менше, ніж 5 хвилин і виконати досліди, описані раніше.
8. Накреслити графік залежності швидкості реакції від умовної концентрації і визначити константу швидкості для температури t2 ( К2 ).
![]()
![]() Взяти значення константи швидкості
при двох температурах і розрахувати температурний коефіцієнт швидкості реакції
g та енергію активації Eа:
Взяти значення константи швидкості
при двох температурах і розрахувати температурний коефіцієнт швидкості реакції
g та енергію активації Eа:
якщо t2 – t1 = 10, то
![]()
якщо t2 - t1 ≠ 10, то
![]() Згідно з
рівнянням Арреніуса:
Згідно з
рівнянням Арреніуса:
К = Ае-Ea/RT , звідки Дж / моль
(R = 8,3 Дж К-1 моль-1 )
2. Хімічна рівновага.
Зміщення хімічної рівноваги при зміні концентрації реагуючих речовин вивчається на прикладі взаємодії феррум (Ш) хлорида і калій роданіда :
FeCl3 + 3KCNS « Fe(CNS)3 + 3KCl
константа рівноваги:
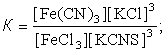 |
Налити в склянку по 10 мл розчинів ферум (ІІІ) хлориду FeCl3 і калій роданіду KCNS. Розлити одержаний розчин у чотири пробірки, одну залишити для контролю. В першу пробірку додати кілька крапель концентрованого розчину ферум (ІІІ) хлориду, в другу – декілька крапель концентрованого розчину калій роданіду, в третю - насипати небагато твердого калій хлориду КСl і струсити пробірку декілька разів, щоб збільшити швидкість розчинення солі. Порівняти забарвлення розчинів у трьох пробірках з кольором контрольного розчину. Записати свої спостереження. Пояснити зміни, виходячи з принципу ле Шательє, і записати зроблені висновки.
РОЗЧИНИ ЕЛЕКТРОЛІТІВ
Мета роботи: ознайомлення з методами визначення водневого показника середовища і визначення зміщення іонних рівноваг.
Дослід 1. Залежність рН розчину ацетатної кислоти від концентрації.
Розрахунок ступеня дисоціації.
За допомогою універсального індикаторного паперу визначити рН розчину ацетатної кислоти з концентраціями 1М і 0,01М. Для цього скляною паличкою перенести 1-2 краплі досліджуваного розчину на універсальний індикаторний папір і порівняти забарвлення ще сирої плями з кольоровою шкалою. Записати рівняння реакції дисоціації і вираз для константи дисоціації ацетатної кислоти. Визначити ступінь дисоціації кислоти, враховуючи , що вона є слабким електролітом :
a =![]() ;
Кд (кисл) =
1.10-5
;
Кд (кисл) =
1.10-5![]() .
.
Розрахувати рН розчинів ацетатної кислоти, передбачаючи, що концентрація іонів водню в розчині дорівнює концентраціі продисоційованих молекул :
[H+] = aC, pH = -lg [H+].
Одержані дані внести в таблицю і зробити висновок про вплив концентрації на ступінь дисоціації слабкого електроліту.
Концентрація a [H+] pHрозр. рН визн
СН3СООН, моль/л
1
0,01
Дослід 2. Порівняння хімічної активності кислот.
В одну пробірку налити 2 мл 2 н. розчину хлорводневої кислоти, в другу стільки ж 2 н. розчину ацетатної кислоти. В кожну пробірку додати по одному шматочку цинку. В якому випадку водень виділяється енергійніше? Написати іонні і молекулярні рівняння реакцій. Пояснити різницю швидкостей реакцій, які спостерігали.
Дослід 3. Вплив солі слабкої кислоти на дисоціацію цієї кислоти
В дві пробірки помістити по 1-2 мл 0,01М ацетатної кислоти і додати по одній – дві каплі індикатора метилоранжу. Одну пробірку залишити для порівняння, а в другу додати кілька кристалів натрій ацетату і добре перемішати. Порівняти забарвлення в обох пробірках і пояснити його зміни, виходячи з принципу ле Шательє і виразу константи дисоціації ацетатної кислоти. Яку речовину треба додати до розчину слабкої кислоти, щоб змістити рівновагу в бік утворення малодисоційованих молекул?
Дослід 4. Вплив солі слабкої основи на дисоціацію цієї основи
В дві пробірки помістити по 1-2 мл розчину амоніаку і додати по одній краплі розчину фенолфталеїну. В одну пробірку додати кілька кристалів солі амоній хлориду і добре розмішати. Пояснити зміну забарвлення розчину при додаванні солі, виходячи з принципу ле Шательє і виразу константи дисоціації. Яку речовину треба додати до розчину слабкої основи, щоб змістити рівновагу в бік утворення малодисоційованих молекул?
Дослід 5. Зміщення іонної рівноваги в насиченому розчині амфотерного електроліту.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.