3. Сипучі і рідкі речовини для зважування вміщують у заздалегідь зважену посудину (бюкс). Сипучі речовини можна розмістити на попередньо зважений папір певного розміру або на обидві шальки терезів покласти папір однакової маси і потім на лівий папірець насипати зі шпателя сипучу речовину.
4. Предмети, які зважують, повинні мати кімнатну температуру.
5. Масу зважених речовин виражають у грамах. Наприклад, 25 г 620 мг записують так: m(зразка) = 25,62 г, тому що точність зважування 0,01 г.
6. Після закінчення зважування нічого не залишати на терезах. Якщо в одній роботі треба провести кілька зважувань, то слід користуватись одними і тими ж терезами і набором гирок і важків.
Отримати у викладача зразок і зважити його згідно з правилами.
Правила і результати зважування записати у зошиті і перевірити їх у викладача.
Лабораторна робота № 2
ВИЗНАЧЕННЯ МОЛЯРНОЇ МАСИ ВУГЛЕКИСЛОГО ГАЗУ
Мета роботи: вивчення методів визначення молярної маси речовини в газоподібному стані.
Карбон (IV) оксид (вуглекислий газ) добувають у пристрої (рис.2), що складається з апарата Кіппа (1), в якому у середній колбі знаходиться мармур, а у верхній та нижчій колбах – розведена (1:3) хлоридна кислота; склянки Тищенко для осушування газу, де знаходиться концентрована сульфатна кислота (2); колби для збирання газу (3). Вуглекислий газ добувають, діючи розчином хлоридної кислоти НСІ на мармур CaCO3 .
Рис 2. Пристрій для
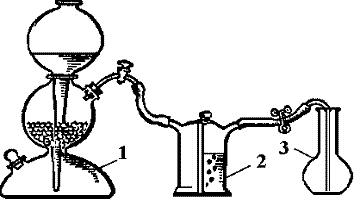 одержання вуглекислого газу
одержання вуглекислого газу
Порядок роботи:
1. Зважити на технохімічних терезах з точністю до 0,01 г суху колбу, закриту щільно пробкою, помітивши рівень, до якого вона входить в колбу. Вагу записати у журнал.
2. Заповнити колбу карбон (IV) оксидом, опустивши трубку від апарата Кіппа до дна колби (протягом 2-3 хвилин).
3. Зважити колбу, заповнену вуглекислим газом і закриту пробкою (пробка повинна входити на ту ж глибину, як і при першому зважуванні). Наповнення і зважування треба проводити два-три рази до одержання сталої маси, тобто коли два послідовних результати будуть відрізнятися один від одного не більш ніж на 0,01 г. Вагу колби з вуглекислим газом записати.
4. Виміряти об’єм вуглекислого газу, для чого заповнити колбу водою до лінії мітки і вилити воду в мірний циліндр, записати об’єм.
5. Записати атмосферний тиск і температуру, при яких виконується дослід.
Запис спостережень.
1. Вага колби з пробкою і повітрям - m1, г.
2. Вага колби з пробкою та карбон (1V) оксидом - m2, г.
3. Об’єм колби V, мл.
4. Температура t, 0C.
5. Абсолютна температура T, K (T = 273 + t 0C).
6. Атмосферний тиск P, мм рт. ст.
Розрахунок молярної маси вуглекислого газу
2. Визначення маси повітря ( m3 ), яке знаходилось у колбі, якщо відомо, що маса 1 л повітря за н.у. дорівнює 1,29 г.
3. Визначення маси водню ( m4) в об’ємі колби, якщо відомо, що маса 1 л водню за н.у. дорівнює 0,09 г.
4. Визначення маси порожньої колби (m5): m5 = m1 - m3 (г).
5. Визначення маси карбон (ІV) оксиду у колбі ( m6) : m6 = m2 - m5(г).
6. Визначення відносної густини вуглекислого газу за повітрям та за воднем:
D пов = m6 / m3 ; DН2 = m6 / m4;
7. Визначення молярної маси карбон (ІV) оксиду:
а) виходячи з відносної густини за повітрям: М1 (СО2) = 29Dпов
![]() б)
виходячи з відносної густини за воднем: М2 (СО2)
= 2DН2
б)
виходячи з відносної густини за воднем: М2 (СО2)
= 2DН2
в) виходячи з молярного об’єму газу:
г) виходячи з рівняння Менделєєва - Клапейрона:
PV = mRT / M ; M 4 (СО2) = m6RT / PVо ,
де R = 62360 мл . мм рт.ст./ (моль.К)
8.
9. 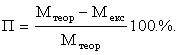 Визначення відносної помилки досліду у
процентах:
Визначення відносної помилки досліду у
процентах:
Лабораторна робота № 3
ВИЗНАЧЕННЯ ЕКВІВАЛЕНТНОЇ МАСИ МАГНІЮ
Мета роботи: ознайомлення з методом визначення еквівалентної маси металів за об’ємом витисненого ними водню з кислоти.
В роботі проводиться визначення еквівалентої маси магнію методом витиснення водню з кислоти згідно з рівнянням :
Mg + H2SO4 Õ MgSO4 + H2 .
Дослідження проводять у приладі, який зображено на рис. 3.
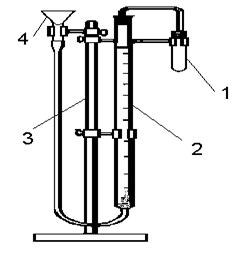 |
1 - реакційна пробірка; 2 - бюретка із гумовим шлангом; 3 - штатив; 4 - лійка
Порядок роботи.
1. Зняти пробірку і у прилад через лійку залити дистильовану воду до нульової відмітки. Для витиснення повітря з приладу лійку кілька разів опустити і підняти догори. При цій дії з приладу виходять пухирки повітря.
2. Перевірити прилад на герметичність. Для цього з’єднати пробірку з бюреткою, закриваючи щільно пробки. Опустити лійку на 10-15 см. Якщо рівень води трохи знижується і зупиняється, то можна вважати, що прилад герметичний. Якщо рівень води постійно знижується, треба щільно закрити пробки або взяти іншу пробірку. Відмітити рівень води у бюретці (V1).
3. Зважити магній масою 0,04 г, використовуючи цигарковий папірець, і завернути його, як цукерку.
4. Відмірити мірною пробіркою 5 мл розбавленої сульфатної кислоти.
5. Зняти реакційну пробірку з приладу, перелити в неї кислоту через маленьку лійку так, щоб не змочити стінки верхньої частини реакційної пробірки.
6. Перевести реакційну пробірку у нахилене положення і помістити папірець з металом так, щоб він не торкався кислоти.
7. В нахиленому положенні з’єднати пробірку з приладом і привести до контакту метал і кислоту, декілька разів обережно струшуючи пробірку і підтримуючи пробку. Коли почнеться реакція, стежити за тим, щоб вода, яка витиснюється воднем з бюретки, не виливалась на стіл. Після закінчення реакції почекати, доки пробірка не охолоне до кімнатної температури.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.