Молекула одноатомного газа имеет три степени свободы. На каждую степень свободы расходуется MCu /3 = 4,16 кДж/кмоль К . Двухатомные газы имеют пять степеней свободы ( 3 поступательных + 2 вращения ).
Если предположить, что на каждую степень свободы приходится то же колличество энергии = 4,16, то MCu = 5 4,16 = 20,8.
Для трехатомного MCu = 6 4,16 = 24,96.
Экспериментальные значения С для соответсвующих газов качественно подтверждают значения молярных теплоемкостей, найденных расчетным путем. Расхождение между ними видетельствует о том, что кинетическая теория не учитывает внутримолекулярного движения атомов и сил взаимодействия между молекулами. Эти факторы могут быть учтены квантовой теорией:
d2
MCu = d1(MR/2)
+ ![]() MR ((
MR ((![]() /T)2e
/T)2e![]() /T)/( e
/T)/( e ![]() /T-1)2,
/T-1)2,
1
где d1 -
часть степени свободы поступательного и вращательного движения молекулы; d2 - часть
степени свободы внутримолекулярных колебаний; ![]() -
характеристическая температура q = fn, где n - частота колебаний; T - температура газа;
e - основание натурального логарифма.
-
характеристическая температура q = fn, где n - частота колебаний; T - температура газа;
e - основание натурального логарифма.
В теплотехнических установках в качестве РТ часто используются не однородные газы, а их смеси (атмосферный возду).
Если в смеси нет химических реакцией, то она подчиняется основным газовым законам т уравнениям состояния.
Каждый газ, входящий в газовую смесь, оказывает на стенки сосуда давление, величина которого не зависит от присутствия в этом объеме других газов. Такое давление называется парциальным.
Дальтон установил, что при постоянной температуре полное давление смеси нескольких газов, химически не реагирующих между собой, равно сумме их парциальных давлений:
Pm
= 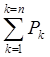 (7.1)
(7.1)
n - количество газов, входящих в смесь.
Количество отдельных газов в смеси может быть задано массовыми gk объемными rk долями. Если смесь газов состоит из n отдельных газов, то:
gk
= mk / ![]() mk = mk
/ mm,
mk = mk
/ mm,
где mk - масса k - го газа в смеси; mm - масса смеси газов:
![]() gk = 1
или 100 %.
gk = 1
или 100 %.
Если смесь задана объемными долями, то:
rk = Vk / Vm, где Vk - парциальный объем k-гогаза, входящего в состав смеси. Vm - молярный объем смеси.
rk = Vk / Vm =( nk (Mu)k),
где nk - количество вещества k-го газа а смеси, моль; (Mu)k - молярный объем k-го газа в смеси.
В
соответствии с законом Авагадро: все газы при одинаковых условиях содержат в
равных объемах равное число молекул ®(Mu)k =const ® rk = nk / nm ® ![]() rk = 1 или 100 %.
rk = 1 или 100 %.
Вывод: объемные и молярные доли численно равны между собой:
rk = gk.
Для k-го газа, находящегося в газовой смеси уравнение состояния может быть записано в виде:
pk uk = RkTm (7.2)
Для молярного объема уравнение состояния будет иметь вид:
pkVMk = RkMkTm ® Rk = 8314,4/Mk ®
Уравнение состояния Клайперона-Менделеева:
pkVk = 8314 Tm (7.3)
Для смеси газов можно записать:
p1Vm = m1R1Tm;
p2Vm = m2R2Tm;
.........................;
..........................;
pnVm = mnRnTm
Vm![]() pk = (m1R1
+ m2R2 + ... + mnRn)*Tm
pk = (m1R1
+ m2R2 + ... + mnRn)*Tm
из уравнения обозначим mmRm
Дальтона
²
pm
Уравнение смеси газов:
pmVm = mmRmTm (7.4)
Разделив все члены выражения (*) на mm, получим выражения для расчета удельной газовой постоянной смеси (mk / mm = gk):
Rm
= ![]() gkRk , RkMk = 8314,4
(7.5)
gkRk , RkMk = 8314,4
(7.5)
Rm
= 8314 ( ![]() gk / Mk) (7.6)
gk / Mk) (7.6)
Вывод: Для определения удельной газовой постоянной не нужно знать Rk для каждого газа. Достаточно знать лишь массовый состав газа gk и мольные доли компонентов газовой смеси.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.