|
|
|
Рисунок 6. Электролитическое железо, азотированное 53 часа в NH3 при 680° и медленно охлажденное. Твердые растворы нитрида Fe2N (a) Fe4N (б). × 1000. |
На рисунок 7 представлена диаграмма состояния железо - азот, построенная по данным других исследователей. На ней α и γ обозначают твердые растворы азота в объемно- и в гранецентрированной решетках железа, а γ'-, ε- и ξ - нитриды, существующие в этом интервале концентраций. γ'-фаза существует в сравнительно узкой гомогенной области и отвечает содержанию азота примерно 6%.
|
|
|
Рисунок 7. Диаграмма состояния железо – азот. |
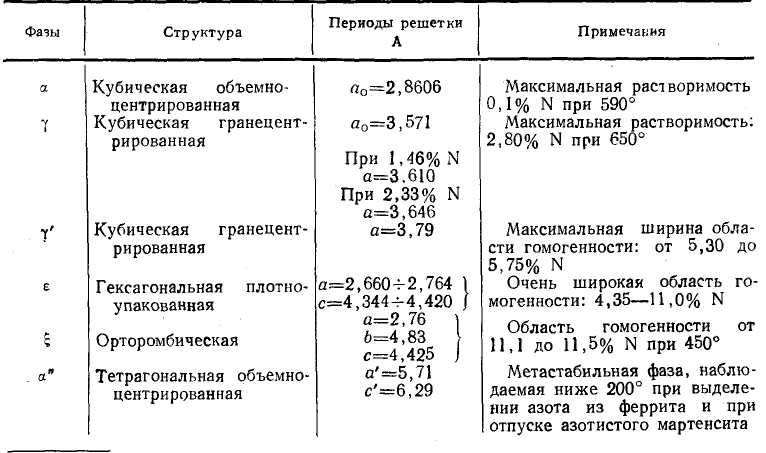
Рентгеноструктурными исследованиями установлено, что этот нитрид имеет кубическую гранецентрированную решетку и в идеальном случае соответствует составу Fe4N. ε-фаза охватывает широкую область концентраций. Она обладает гексагональной плотноупакованной решеткой. Структура ξ-фазы, которой подходит структурная формула Fe2N - орторомбическая. В табл. 1 приведены сведения о периодах решетки и областях гомогенности отдельных фаз, изображенных на диаграмме состояния.
Внедрение атомов азота деформирует кристаллическую решетку α-железа, период его решетки при комнатной температуре увеличивается в среднем на (3,17 ± 0,28) • 10 - 3 А на каждую 0,1% растворенного азота. Поэтому при охлаждении пересыщенных растворов из них выделяются метастабильные фазы: γ' -фаза (Fe4N) в интервале 590 - 300°С и α"-фаза (Fe16N2) ниже 200°С (на диаграмме состояния она не показана). Последняя фаза образуется и при разложении нитроцементита в той же температурной области.
Таблица 1. Фазы в системе железо – азот
Возможные в этих системах метастабильные равновесия выражаются уравнениями:
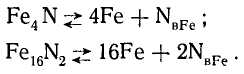 (5)
и (6)
(5)
и (6)
Можно получить эти фазы и азотируя железо аммиаком при низких температурах (выше 200°С), так как химический потенциал азота в аммиаке выше, чем в молекуле N2.
Нитрид Fe4N (γ'-фаза) гомогенен в узком интервале концентраций азота (5,30 - 5,75%). Низший нитрид (α"-фаза) имеет тетрагональную объемноцентрированную решетку, расположение атомов железа в которой то же, что и в решетке α-железа. Поэтому, для образования зародышей α"-фазы требуется значительно меньшая энергия активации, чем для зародышей γ' -фазы.
При разложении твердого раствора частицы α"-фазы располагаются в виде тонких пластин (дисков), видимых при увеличении 40000 и ориентированных по плоскости (100), параллельной соответствующей габитусной плоскости феррита. Ниже 300°С выделение γ'-фазы еще заторможено, т. е. равновесие реакции (6) метастабильно не только к газовой фазе, но и по отношению системы α-твердый раствор - γ'-фаза. С повышением температуры первоначальные образования α"-фазы превращаются в γ-фазу, и количество растворенного в железе азота изменяется по реакции (5). Согласно исследованиям, в холоднокатаном чистом железе частицы нитрида Fe4N ориентированы близко к плоскости (012).
Из диаграммы состояния (см. рисунок 7) видно, что между богатым железом твердым раствором и γ'-фазой образуется эвтектоид, называемой браунитом (см. рисунок 6). Структура браунита редко выявляется так четко, как структура перлита, он скорее напоминает троостит.
Наиболее известным структурным признаком содержащего азот железа являются иглы нитридов, которые можно легко распознать в азотированном электролитическом железе (см. рисунок 5). Еще яснее они видны на рисунок 8. Эти иглы нитридов, образующиеся преимущественно внутри зерен, в основном состоят из γ'-фазы; из рисунок 9 видно, что азот проникает преимущественно по границам зерен. На этом рисунке ясно различаются скопления нитридов по границам зерен, в то время как внутри зерен наблюдаются только мелкораспределенные иглы этой фазы.
|
|
|
Рисунок 8. Иглы нитридов железа. |
|
|
|
Рисунок 9. Нитриды железа в электролитическом железе, азотированном 12 час. в NH3 при 680° и закаленном от 550°. |
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.