Значение теплоты адсорбции азота сохраняется постоянным вплоть до 750° С, что свидетельствует о едином механизме адсорбции в этом интервале температур. Теплота десорбции составляет около 230 КДж/моль (55 Ккал/моль).
Выше 200 - 300° С адсорбция азота на железе изучена недостаточно подробно.
1.2 Диффузия
При определении коэффициентов диффузии азота в железе разными исследователями использовались разные методы. Одни измеряли скорость поглощения азота образцами определенной формы в атмосфере, состоящей из 95% N2 и 5% Н2; другие измеряли скорость его выделения в неосушенном водороде. Содержание азота в образцах контролировали методом внутреннего трения и химическим анализом. Авторы одной из работ, измерявшие DN в интервале 750 - 873 и 1410 - 1470°С, рекомендуют для вычисления коэффициента диффузии азота в феррите формулу:
![]()
Или
![]() (1)
(1)
Вычисленные по этой формуле значения хорошо совпадают с результатами других исследователей, измерявших DN при 500 и 600° С. Для железа в γ-области значения DN получены Гривисоном и Тэркдоганом, проводившими исследования в интервале 1000 - 1200° С. По формуле этих авторов
![]()
Или
![]() (2)
(2)
при 950°С DN = 5,8 • 10 - 8 см2/сек, что близко совпадает с единственным значением DN для γ-области, определенным Фастом и Веррьюпом (6,5 • 10 - 8 см2/сек при той же температуре).
Ниже приведены значения DN, рассчитанные по формулам (1) и (2):

Как видно, скорость диффузии азота в феррите значительно выше, чем в аустените, и в точке перехода α→γ уменьшается примерно на два порядка.
1.3 Растворимость
Система железо — азот может находиться в состояниях истинного и метастабильных равновесий. Истинное равновесие характеризуется уравнением
![]() (3)
(3)
Ниже примерно 600° С абсорбция и десорбция газообразного азота заторможены значительной энергией активации поверхностных реакций, а объемно-центрированная решетка α-железа способна удержать значительно больше азота, чем это возможно по реакции (3).
Работами А. Сивертса, В. И. Явойского и А. Н. Морозова установлены основные закономерности растворения азота в жидких и твердых металлах. Растворимость азота подчиняется закону Сивертса:
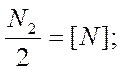
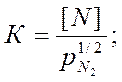
В результате обобщения экспериментальных данных многих исследователей получено уравнение для растворимости азота в жидком железе в зависимости от температуры и парциального давления азота:
![]() (4)
(4)
В. И. Явойский и А. Г. Свяжин исследовали растворимость азота в чистом жидком железе методом взвешенной капли в высокотемпературном интервале (1710 - 2600°С). В результате было получено следующее соотношение:
![]()
Третье слагаемое приведенного соотношения описывает поправку на нелинейность зависимости lg [N] от 1/Т, связанную с испарением железа при высоких температурах и понижением вследствие этого парциального давления азота вблизи поверхности капли.
Тепловой эффект растворения азота ( - ΔНт0) в α- и δ-железе равняется 60,3 кДж/моль (7200 кал/г-атом), а в γ-железе - + 16,9 кДж/моль ( + 2020 кал/г-атом).
Ниже приведены рассчитанные по формулам значения (N, %) в железе при различных температурах:
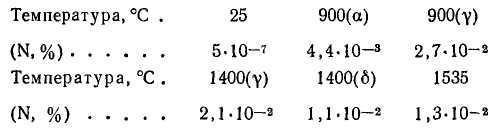
Как видно, растворимость азота в гранецентрированной решетке γ-железа значительно выше, чем в объемно-центрированной, и уменьшается с повышением температуры (рисунок 1).
|
|
|
Рисунок 1. Концентрация азота в железе при равновесии с газообразным азотом и давлении 1 ат. |
При температурах структурных превращений и в точке плавления абсорбционная способность железа скачкообразно изменяется.
Результаты исследований разных авторов растворимости азота в железе, проведенных примерно в одно время, показаны ниже:

В соответствии с этими данными можно принять растворимость азота в чистом железе равной 0,044% при 1600°С, а температурный коэффициент растворимости 1,0 • 10 -5 % на 1°С. В этом случае растворимость описывается уравнением (4), а тепловой эффект растворения азота в жидком железе равняется 14,3 кДж/моль ( - 1715 кал/г-атом).
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.