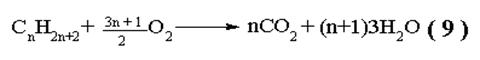 |
При горении развивается высокая температура, поэтому низшие углеводороды используются в качестве бытового и технического топлива. Смесь (1СН4 + 2О2) называется “гремучей”, - она взрывается от малейшей искры, а её образование (рудничный газ) является одной из главных причин взрывов в угольных шахтах.
Итак, алканы способны к реакциям четырёх типов: замещения, отщепления, расщепления и изомеризации. Алканы не могут вступать в реакции присоединения и соединения.
Лабораторных методов получения алканов – немного.
1)
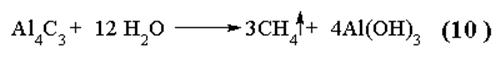 |
2)
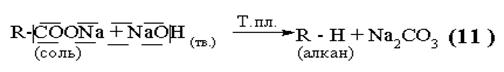 |
В результате реакции углеродная цепь исходного соединения укорачивается на один атом углерода.
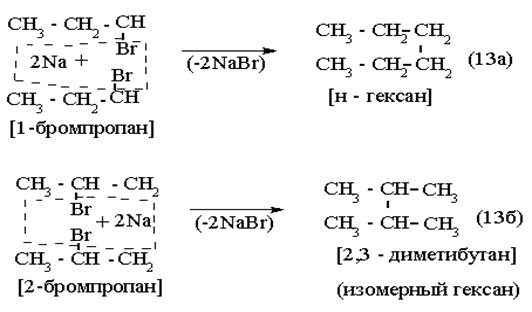
3)
 |
Связь образуется между теми атомами углерода, которые в исходных галогенидах были связаны с галогеном:
 |
Циклоалканы (цикланы) – предельные, насыщенные углеводороды, имеющие в структуре карбоциклы. Все связи между атомами - s - типа.
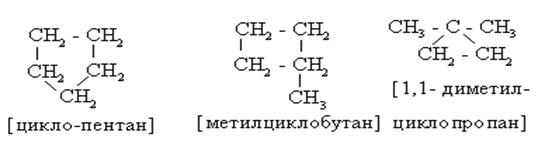 |
Источников изомерии цикланов – три:
(а) размер цикла;
(б) различное положение заместителей в кольце;
(в) изомерия боковой цепи.
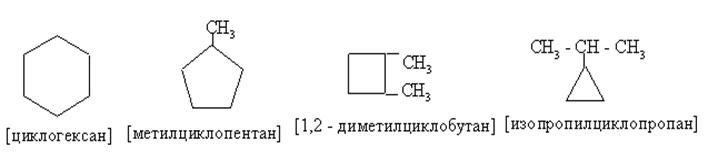 |
По физическим и химическим свойствам цикланы, начиная с ц-С5, очень похожи на обычные алканы.
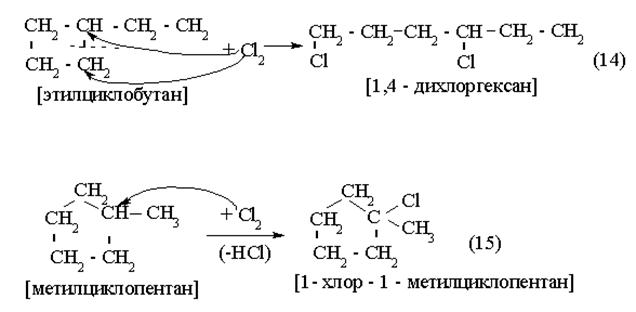 |
Реакция (14) – присоединение; Реакция (15) – замещение.
Алкены или этиленовые углеводороды (олефины, от лат. oleum = масло)- первый класс непредельных, ненасыщенных органических соединений. Они относятся к группе алифатических углеводородов – имеют незамкнутые углеродные цепи и содержат в структуре одну двойную (С = С) связь.
Атомы углерода при двойной связи находятся во втором валентном состоянии – sp2 – гибридизация (см. рис.7).
Первым представителем и “ родоначальником” гомологического ряда является этилен Н2С = СН2 (структуру см. рис.11). Общая формула гомологического ряда этиленовых углеводородов СnH2n, т.е., по сравнению с алканами, у алкенов недостаёт одной пары атомов водорода, почему они и называются ненасыщенными.
По (Р.н.) алкены рассматриваются как производные этилена, в молекуле которого один или несколько атомов водорода замещены на радикалы. Поскольку возможны варианты замещения, “этиленовые” атомы углерода предварительно обозначаются
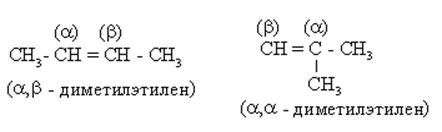 |
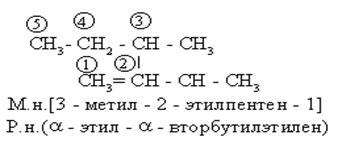 |
В номенклатуре органических соединений различных классов часто используется название радикала этилена: H2C=CH- винил.
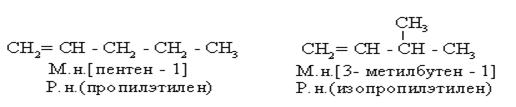 |
1) Изомерия С – скелета
 |
3)Цис – транс изомерия.
 |
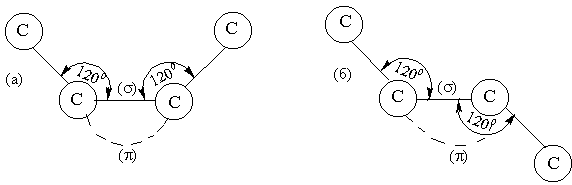 |
Модели углеродных скелетов изомеров бутен – 2:
(а) цис-, (б) транс-.
Факт наличия двойной связи в структуре углеводорода обнаруживается сопоставлением конкретной молекулярной формулы (Б.ф.) с общей формулой алкенов (СnH2n). В случае их соответствия (например, C6H12) строится цепь из соответствующего числа углеродов и ставится двойная связь между любыми соседними углеродами, а формула дополняется атомами водорода.
Следует подчеркнуть, что формула СnH2n является общей и для алкенов, и для циклоалканов, которые являются между собой изомерами, хотя представляют разные классы органических соединений, - метамерия.
По [М.н.]:
1) Строится длинная С – цепь и нумеруются её атомы;
2) Расставляются по “адресам” двойная связь и радикалы;
3) Формула дополняется атомами Н.
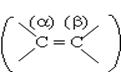
По (Р.н.):
1)
 |
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.