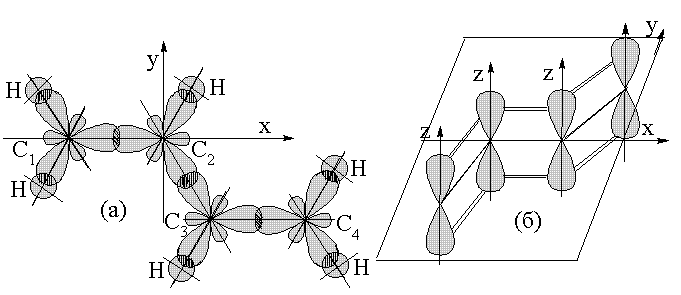
 |
Именно особенностями электронной структуры обусловлены необычные свойства сопряженных диенов, в частности 1,4 – присоединение и полимеризация. После разрыва обеих двойных связей (С1 = С2) и
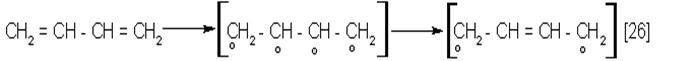 |
Не спаренные электроны С1 и С4 участвуют в образовании новых связей в реакциях 1,4 – присоединения (27) и полимеризации (28).
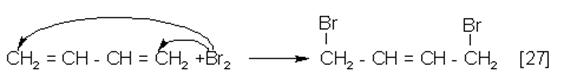 |
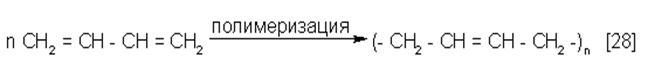 |
В полимерных цепях каучука сохраняется часть двойных связей, за счет которых впоследствии длинные цепи молекул неупругого каучука “ сшиваются” атомами серы в поперечных направлениях (вулканизация), образуя пространственно – сшитый упругий полимер – резину. Замещая в молекуле дивинила атомы водорода на другие атомы или группы атомов, получают каучуки различных составов (изопреновый, хлоропреновый и др.) и, соответственно, с различными свойствами.
1)
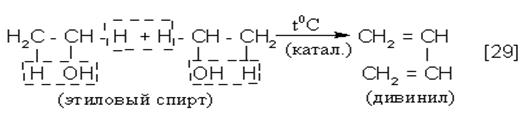 |
2)
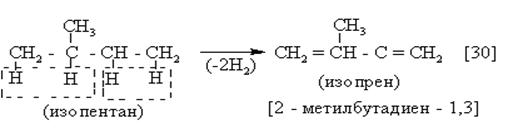 |
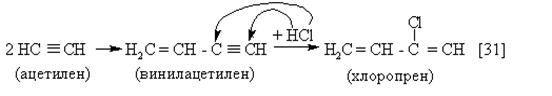 |
Алкины (ацетиленовые углеводороды) – молекулы, имеющие в структуре одну тройную углерод - углеродную связь и относящиеся к группе алифатических углеводородов с общей формулой СnH2n-2. Как и диены, имеют две p-связи, но обе – между одной парой атомов углерода.
Углероды при тройной связи находятся в третьем валентном состоянии (sp – гибридизация).
Первым представителем и “ родоначальником” гомологического ряда алкинов является ацетилен НСºСН. Все гомологи представляются как продукты замены в молекуле ацетилена атомов водорода на алкилы, откуда и (Р.н.) алкинов.
Для наименования по [М.н.] нумеруется С – цепь со стороны тройной связи. Наличие тройной связи в С – цепи обозначается суффиксом “ин”, а её положение в цепи номером углерода, после которого она находится.
Источников изомерии алкинов всего два: изомерия С – скелета и различное положение (СºС) связи.
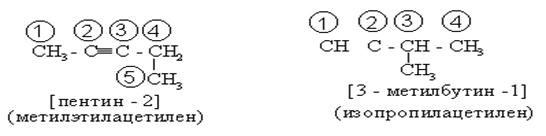
º
Первые алкины (до С4) – газы; С5 – С15 – жидкости; с С16 – твердые вещества; легче воды (r£ 0,75), плохо растворяются в воде.
Ацетилен, в отличие от этилена, очень хорошо растворяется в ацетоне, на чем основано разделение их смеси.
Являясь сильно ненасыщенными и имея в структуре две p-связи, алкины высокореакционноспособные соединения. Главное их свойство – способность к реакциям присоединения (соблюдается правило Марковникова – р.19):
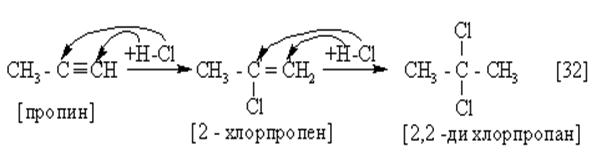 |
Ацетиленовые углеводороды обесцвечивают бромную воду:
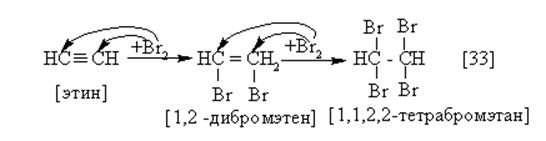
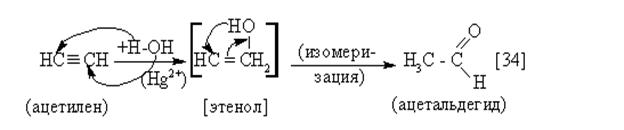 |
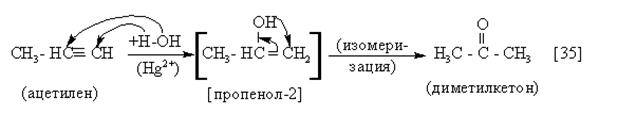 |
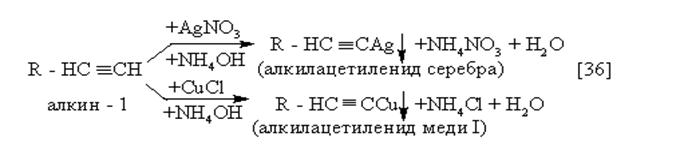 |
Выпадение осадков ацетиленидов - качественная реакция на ацетиленидный водород (на алкины – 1).
 |
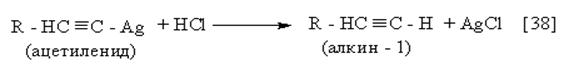 Действием
соляной кислоты на ацетиленид исходный алкин регенерируется:
Действием
соляной кислоты на ацетиленид исходный алкин регенерируется:
 |
Присоединение HCl к винилацетилену даёт хлоропрен
H2C=CH-CCl=CH2 , идущий на производство хлоропренвого каучука – см. р.31.
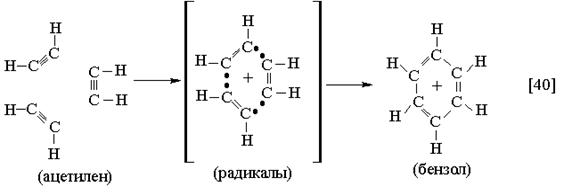 |
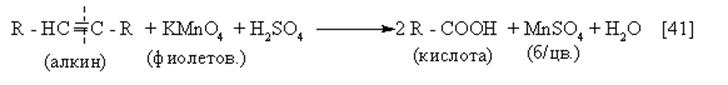 |
Реакция идёт с полным разрывом тройной связи и образованием из “осколков” алкина карбоновых кислот.
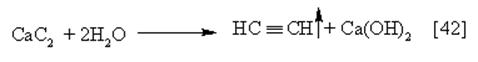 |
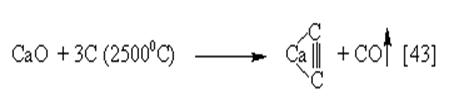
Реакция протекает очень бурно. Карбид (ацетиленид) кальция получают обжигом смеси негашеной извести с углем без доступа воздуха:
 |
Гомологи ацетилена могут быть получены через ацетилениды
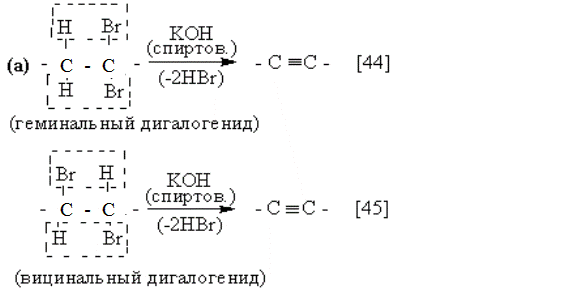 |
дигалогенидов:
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.