Главным видом химической связи в органических молекулах является ковалентная связь. Возможны три способа разрыва ковалентной связи, на которых базируются три типа механизмов органических реакций:
1)
 |
2)
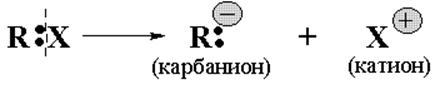 |
Возникающие в результате гетеролитических разрывов ковалентной связи органические ионы (R+ или R-) - активные,
заряженные, неустойчивые частицы, время жизни которых незначительно. Соответственно, есть электрофильные и нуклеофильные реакции, протекающие с участием органических ионов.
3)
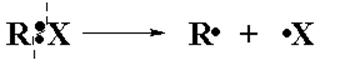 |
Здесь, в результате разрыва ковалентной связи, возникает пара свободных радикалов – неустойчивых, короткоживущих незаряженных частиц с неспаренными электронами.
Образоваться свободные радикалы могут термически (t0C), радиационно (hn) и под другими воздействиями на реагенты. С участием радикалов протекает большинство органических реакций, в частности, цепные реакции.
Свободно-радикальный механизм цепных реакций (акад. Н.Н. Семёнов, Нобелевская премия 1956 г) имеет три стадии (на примере хлорирования метана):
![]() 1) Инициирование цепи Cl2 hn 2Cl·
1) Инициирование цепи Cl2 hn 2Cl·
(освещение)
![]()
![]() 2) Развитие цепи СН4 + Cl·
Н3С· + HCl
2) Развитие цепи СН4 + Cl·
Н3С· + HCl
![]() Cl2 + Н3С· Н3СCl
+ Cl·
Cl2 + Н3С· Н3СCl
+ Cl·
3) Обрыв цепи (рекомбинация)
![]()
![]() Cl· + ·Cl
Cl2
Cl· + ·Cl
Cl2
![]() Н3С· + ·Cl Н3СCl
Н3С· + ·Cl Н3СCl
![]() Н3С· + ·CH3
Н3С – CH3
Н3С· + ·CH3
Н3С – CH3
По третьей стадии – обрыв цепи – хорошо видно, откуда “берутся” побочные продукты органических реакций (здесь – этан). Главный ожидаемый продукт – хлорметан.
В органических реакциях выход ожидаемого продукта обычно невысок (80 ¸ 40%). Это связано с тем, что в процессе его получения идёт не одна реакция, а несколько (все их, кроме главной, называют побочными). Поэтому органическую реакцию часто записывают не уравнением, а схемой, которая показывает исходное органическое вещество и главный продукт реакции, стрелкой – направление превращения, под стрелкой – побочный продукт реакции. Использование схем реакций особенно удобно при описании многостадийных процессов.
Количество реакций в которые могут вступать многочисленные органические соединения – огромно. По характеру изменений, происходящих с ”главной” органической молекулой все реакции делятся на шесть типов:
1) ЗАМЕЩЕНИЯ; 4) ИЗОМЕРИЗАЦИИ;
2) ОТЩЕПЛЕНИЯ; 5) РАСЩЕПЛЕНИЯ;
3) ПРИСОЕДИНЕНИЯ; 6) СОЕДИНЕНИЯ.
Суть реакций каждого типа разбирается при рассмотрении химических свойств конкретных классов органических соединений.
Главным химическим свойством алканов является их способность к реакциям ЗАМЕЩЕНИЯ.
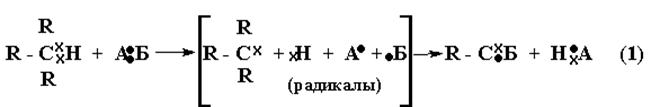 |
На схеме электроны обозначены по разному для показа их происхождения во вновь образованных связях. Запись в квадратных скобках – распространенный в органической химии способ показа неустойчивой (промежуточной) стадии процесса.
Атом Н в молекуле R – H может быть замещён различными атомами или группами атомов, например:
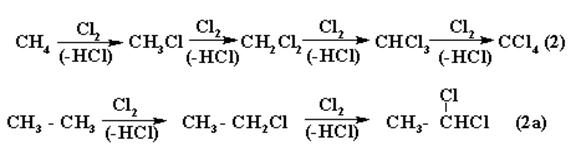 |
б) Нитрование.Процесс идёт при повышенных температуре и давлении или под действием нитрующей смеси (HNO3 конц+ H2SO4 конц.) – без нагрева. Атом водорода при этом замещается на нитрогруппу – NO2.
Ещё в 1875 г А.М. Зайцев сформулировал эмпирическое (опытным путём установленное) правило:
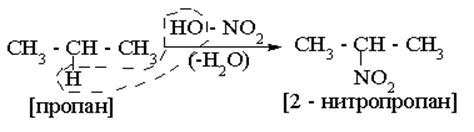 |
Позднее эта закономерность объяснилась очень просто:
прочность связей С – Н для (I), (II) и (III) соответственно, 410, 395 и 380кДж/моль,
т.е. наименее прочная связь между третичными С и Н.
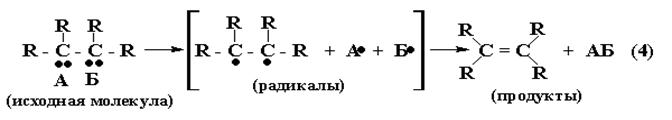 |
От двух соседних атомов исходной молекулы отщепляются радикалы А· и Б· , которые объединяются в молекулу АБ.
Не спаренные электроны соседних углеродов исходной молекулы объединяются в общую электронную пару, т.е. образуется вторая связь в дополнение к уже имеющейся, - возникает двойная (С=С) связь.
С позиций КММ: атомы углерода исходной молекулы после ухода
А· и Б· переходят из первого (sp3) во второе (sp2) валентное состояние (рис.6б), и между ними образуется p - связь в дополнение к уже имеющейся s - связи (рис.10а).
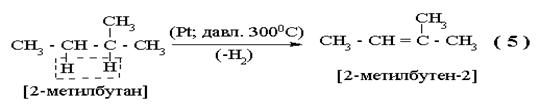 |
В этом случае также соблюдается правило Зайцева (отщепляются (III) и (II) водороды, но не первичный).
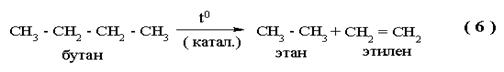 |
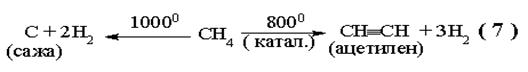 |
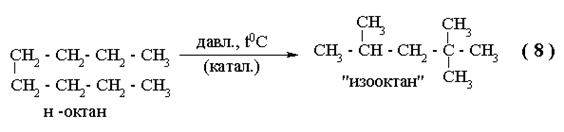 |
Углеводороды в природе, в основном, неразветвленные.
Наиболее технически – ценными свойствами обладают разветвленные.
Изооктан – тривиальное название 2,2,4 – триметилпентана – эквивалент октановой шкалы топлив.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.