*Есть и двух-, и трехвалентные радикалы, - здесь на рассматриваются.
Номенклатура – свод общепринятых правил наименования химических соединений – язык химии, средство обмена химической информацией.
Задач у номенклатуры – две:
1) дать название структурной формуле;
2) по названию воспроизвести структурную формулу.
Есть органические соединения, которые давно и широко используются и имеют тривиальные (исторически сложившиеся) названия, под которыми и известны, например: метан, этилен, ацетилен, ацетон, толуол, кислоты – уксусная, яблочная, молочная, лимонная и т.д. Запомнить их все трудно по причине многочисленности. Выход: система правил, по которым составляются названия соединений.
Принцип – сложное соединение представляется как производное простого, в молекуле которого один или несколько атомов водорода заменены на углеводородные радикалы (алкилы).
Базовыми для номенклатуры всех органических соединений (не только углеводородов) являются названия членов гомологического ряда метана, греческих числительных и радикалов.
Для рациональной ( от лат. Ratio – разум) номенклатуры любой сложный алкан представляется как производное метана, в молекуле которого атомы водорода (“как будто бы”) заменены на радикалы.
В качестве “метанового” выбирается углерод, который связан с несколькими заместителями, а замещающие группы (радикалы) при этом можно назвать.
Название соединения по (Р.н.) составляется перечислением радикалов (в порядке возрастания их сложности) с добавлением слова “метан”. Если имеется несколько одинаковых радикалов, то называется их количество греческим словом (ди-, три-, тетра- и т.д.) и название радикала (R) в единственном числе. Название соединения записывается одним словом.
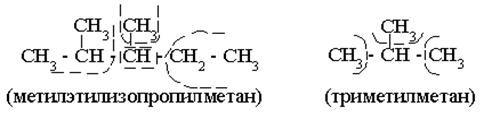 |
[М.н.] – свод правил Комиссии по номенклатуре органических соединений при международном союзе Чистой и Прикладной Химии – IUPAC (ИЮПАК).
Для [М.н.] любой разветвленный алкан представляется как производное углеводорода с самой длинной С – цепью в данной молекуле. Поскольку замещения могут быть в разных местах
С – цепи, - атомы углерода выбранной длинной цепи предварительно нумеруются.
Порядок использования [М.н.]:
1) Выбирается самая длинная непрерывная С – цепь (от первичного до первичного углерода).
2) Нумеруются углероды этой цепи с того конца, к которому ближе ответвления (или больше ответвлений).
3) Записывается название соединения в следующем порядке:
а) цифра (№ углерода) – “адрес” радикала;
б) через дефис (-) – название радикала;
в) название “базового” углеводорода, - название члена ГРМ пронумерованной C – цепи;
г) если несколько разных R, - последовательно перечисляются “адреса” и названия каждого радикала;
д) если несколько одинаковых R, - сначала цифрами перечисляются все их “адреса”, затем (через дефис) их количество греческим словом (табл.6) и название R в единственном числе.
При записи [М.н.]:
(а) Количество “адресов” (цифр)должно соответствовать количеству заместителей;
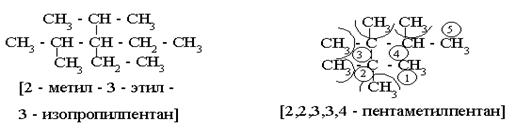 |
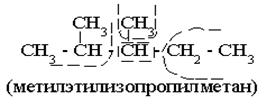 |
Б) По [М.н.]:
1) Строится длинная С – цепь и нумеруется;
2) Расставляются по “адресам” радикалы;
3)
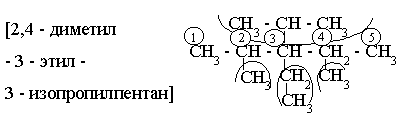 |
Построение изомеров
1)Строятся из заданного количества атомов углерода несколько С – скелетов, отличающихся друг от друга числом и местом положения в С – цепи третичных и четвертичных углеродов (например, для изомеров гексана С6Н14):
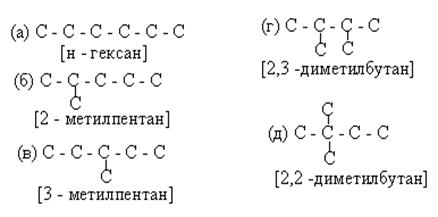 |
3) В случае большего числа углеродов в заданной молекуле можно менять вид радикалов (например, вместо двух метилов один этил у С*3 и т.д.).
Ответвление в С – цепи может быть не раньше, чем у второго углерода от конца цепи. При этом у второго С – не больше, чем метил, у третьего С – этил или изопропил, у четвёртого С от конца С – цепи - пропил или любой изомерный бутиловый радикал. В противном случае изменится выбранная длина цепи:
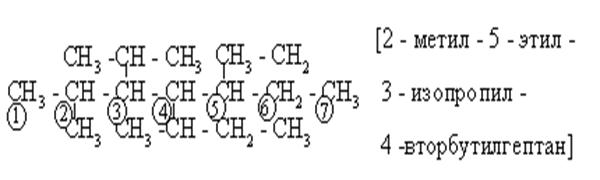 |
 |
Первые углеводороды ряда метана (С1 ¸ С4) – газы при 1 атм. и 250С; (С5 ¸ С15) – жидкости; с С16 – твердые вещества. Все алканы легче воды (см. плотность в табл.7); в воде не растворимы,
Растворяются в органике и сами являются органическими растворителями.
Концентрированные кислоты (серная, азотная), щелочи (КОН, NaOH), металлы, в том числе щелочные, окислители при обычных условиях не действуют на алканы. Отсюда их старое название “парафины” (от лат. parum affinus = лишенные сродства).
На свету, при повышенной температуре и давлении алканы могут вступать в разнообразные химические реакции.
Уравнение химической реакции это “черный ящик”: знаем, что “на входе” (вид реагентов), и что “на выходе” (вид продуктов), но не известно как происходит превращение реагентов в продукты. Представление об этом даёт механизм реакции, - последовательность всех элементарных изменений (стадий), происходящих с реагирующими молекулами в процессе химической реакции.
Поскольку химическая реакция – это разрыв одних связей и образование других, - механизм реакции (модель процесса) включает в себя характер разрыва “старых” связей и способ возникновения связей “новых”.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.