Все твердые тела можно разделить на две группы:
1. Упорядоченные структуры (или кристаллы).
2. Неупорядоченные структуры (например, стекло).
Однако, даже в жидкости (определённо подготовленной) при определённых внешних воздействиях (напр., электрическое поле) при постоянно поддерживаемых термодинамических параметрах могут возникать явления похожие на кристаллы - жидкие кристаллы.
Итак, мы рассмотрели свойства идеальных кристаллических решеток и поведение в них электронов. Однако, кроме идеальных кристаллов большой научный и практический интерес представляют тела, в которых порядок в расположении атомов каким-либо образом нарушен. При этом нужно различать следующие случаи.
Если нарушение порядка имеет место локально, в окрестности отдельных атомов,— нарушен ближний порядок (например, отсутствие в узле атома или наличие в узле атома другого сорта, приводящее к отклонению строения решетки от идеальной). При этом мы имеем дело с дефектами. Если нарушение порядка происходит вдоль некоторых линий или плоскостей в кристалле, то мы имеем дело с дислокациями. Физика дефектов и дислокаций будет изложена отдельно в разделе.
Кроме локальных нарушений порядка может быть ситуация, когда дальний порядок сохраняется лишь вдоль определенных направлений, тогда как вдоль других имеет место лишь ближний порядок. Такая ситуация возможна в так называемых анизотропных жидкостях (жидких кристаллах). Изучение подобных систем будет проведено в разделе о кооперативных явлениях.
Наконец возможны ситуации, когда в отсутствие дальнего порядка имеет место лишь ближний. В этом случае имеем дело с неупорядоченными системами типа жидкостей и аморфных твердых тел. Жидких неупорядоченных систем существует несколько видов: классические диэлектрические жидкости, жидкие полупроводники и жидкие металлы. Такие системы имеют свои особенности и специфические методы изучения, поэтому в настоящем пособии они не рассмотрены.
Что касается некристаллических (аморфных) твердых тел, то важнейшими их представителями являются легированные кристаллы и стекла. К первым относятся, например, полупроводники, легированные примесями, сплавы, компоненты которых входят в состав не в стехиометрических соотношениях и т. д. Ко второму типу относят некристаллические вещества, способные расплавляться и отвердевать обратимо. На рис. 10 показана схема расположения атомов в стеклах, например SiO2 (9а); рядом (9б) изображена типичная двумерная кристаллическая решетка с дальним порядком. Хорошо видно различие в строении этих тел.
|
|
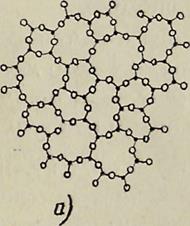
Рис. 9
1. СВОЙСТВА КРИСТАЛЛИЧЕСКИХ ТВЁРДЫХ ТЕЛ
1.1 Простейшие свойства кристаллических структур
Существует большое разнообразие свойств кристаллических тел. Наиболее общим является свойство упорядоченности расположения частиц, образующих кристалл. Кристаллы могут состоять из взаимодействующих между собой атомов, ионов, молекул и образовывать элементарную ячейку. Весь кристалл любых размеров, насколько бы большим он не был, может быть набран, как из кубиков, повторением элементарной ячейки.
Кристаллы можно характеризовать по типу сил взаимодействия между частицами его образующими.
1.1.1. Типы связей
1. Молекулярная связь.
Взаимодействия частиц с молекулярной связью определяется потенциалом Ленарда-Джонса (потенциал “шесть-двенадцать”)
U(r) = UОТ (r) – UПР (r) = 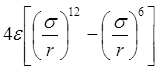 .
.
Это типичный пример связи для
инертных газов (Ar, Kr, Xe), у которых полностью заполнена электронная оболочка,
которая может деформироваться, вследствие чего возникает дипольный момент.
Взаимодействие дипольных моментов и приводит к потенциалу Ленарда-Джонса.
Характерная энергия связи частиц в кристалле Uсв = ![]()
![]() .
.
Ковалентная связь.
Определяется чисто
квантовыми силами. Осуществляется, если взаимодействующие частицы обладают
противоположно направленными спинами s1 и s2 (рис.1.1).
Характерная энергия связи частиц в кристалле Uсв = ![]()
![]() . Типичный
представитель – углерод в форме алмаза.
. Типичный
представитель – углерод в форме алмаза.
2. Ионная связь.
Она определяется кулоновским взаимодействием. Типичный представитель с
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.