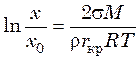 , (41.15)
, (41.15)
где ![]() –
концентрации пересыщенного и насыщенного растворов;
–
концентрации пересыщенного и насыщенного растворов; ![]() –
поверхностное натяжение;
–
поверхностное натяжение; ![]() – молекулярная
масса;
– молекулярная
масса; ![]() – плотность вещества;
– плотность вещества; ![]() – радиус частицы;
– радиус частицы; ![]() – универсальная газовая постоянная;
– универсальная газовая постоянная; ![]() – абсолютная температура.
– абсолютная температура.
Отношение концентраций (х/х0) называется степенью
пересыщения. Из уравнения (41.15) следует, что чем меньше размер
образовавшегося зародыша кристалла ![]() , тем большая степень
пересыщения требуется для его существования.
, тем большая степень
пересыщения требуется для его существования.
В специальной литературе представлены зависимости для оценки вероятности
и скорости возникновения зародышей, анализ которых показывает, что вероятность
образования зародышей возрастает с повышением пересыщения раствора и
увеличением переохлаждения раствора ![]() . Однако, при увеличении
. Однако, при увеличении
![]() уменьшаются температура системы
уменьшаются температура системы ![]() и скорость движения молекул. В результате
противоположного влияния этих эффектов скорость образования зародышей вначале
возрастает, при оптимальной
и скорость движения молекул. В результате
противоположного влияния этих эффектов скорость образования зародышей вначале
возрастает, при оптимальной ![]() проходит через максимум
и затем снова снижается.
проходит через максимум
и затем снова снижается.
При гетерогенном образовании зародыши формируются на мельчайших частицах примесей, взвешенных в растворе или расплаве. Скорость гетерогенного образования, как правило, значительно выше, так как наличие в растворе твердых частиц способствует образованию на их поверхности кристаллической фазы.
Кроме этого, скорость образования зародышей может существенно увеличиться при механических воздействиях на раствор (встряхивание, удар, вибрации и др.). Большое влияние оказывают также шероховатость и материал стенок аппарата, перемешивание, акустические колебания, электрические и магнитные поля, наличие в растворе поверхностно-активных веществ и многие другие факторы. В большинстве случаев все эти факторы увеличивают скорость зарождения кристаллов. Однако, количественные закономерности процесса образования зародышей в промышленных условиях приходится определять экспериментальным путем.
41.5.2. Рост кристаллов
После возникновения в условиях пересыщенного раствора устойчивых зародышей кристаллов на их поверхности начинает откладываться растворенное вещество. Величина линейной скорости роста кристалла или увеличения с течением времени его массы, является основной характеристикой этой стадии процесса.
В настоящее время предложены различные теории роста кристаллов, наиболее важными из которых являются: термодинамическая теория или теория поверхностного натяжения Гиббса‑Кюри‑Вульфа, диффузионная теория роста, молекулярно-кинетическая теория послойного роста кристаллов, предложенная Фольмером, Брандесом и развитая Косселем и др., теория идеального роста кристалла Косселя‑Странского.
Термодинамическая теорияилитеория поверхностного натяженияпостулирует, что кристалл принимает такую совместимую с его симметрией форму, при которой его свободная поверхностная энергия является минимальной. В соответствии с этой теорией удельные поверхностные энергии граней пропорциональны скоростям их роста в направлении, перпендикулярном граням. Скорость роста различных граней кристалла зависит от количества частиц (узлов плоской решетки), приходящихся на единицу их поверхности, или, другими словами, от решетчатой (ретикулярной) плотности граней. Согласно этой теории в кристаллах преимущественное развитие имеют наиболее медленно растущие грани, и кристалл данного вещества может иметь только одну, характерную для данного вещества форму, что не всегда соответствует экспериментальным данным. Эта теория не может объяснить конечную форму кристаллов и не раскрывает механизма их роста.
Диффузионная теория рассматривает рост кристалла как массообменный процесс в соответствии с уравнением массоотдачи:
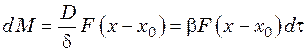 , (41.16)
, (41.16)
где ![]() –
количество массы;
–
количество массы; ![]() – коэффициент диффузии;
– коэффициент диффузии; ![]() – толщина диффузионного слоя;
– толщина диффузионного слоя; ![]() – поверхность растущего кристалла;
– поверхность растущего кристалла; ![]() – концентрация в растворе и на
поверхности кристалла;
– концентрация в растворе и на
поверхности кристалла; ![]() – время.
– время.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.