ЛЕКЦИЯ 41
Кристаллизация
41.1. Общие сведения
Кристаллизациейназывают процесс выделения твердого вещества в виде кристаллов из его растворов или расплавов. Процессы кристаллизации широко используют в химической технологии для получения твердых чистых минеральных солей и других веществ, разделения различных смесей на фракции, очистки веществ от примесей, выращивания монокристаллов и др. Осуществляемое в промышленности одновременное выделение большого количества кристаллов называется массовойкристаллизацией.
Твердые тела по своей структуре могут быть кристаллическими и аморфными. Характерной особенностью кристаллов является строго определенное, периодически повторяющееся в трех измерениях расположение атомов, ионов или молекул, образующих кристаллическую решетку. Отличительным признаком кристаллического состояния вещества является наличие у него четко выраженной температуры плавления, при которой вещество из твердого состояния переходит в жидкое состояние. Температура обратного перехода из жидкого состояния в твердое называется температурой кристаллизации. Температуры кристаллизации и плавления часто не совпадают, что обусловлено особенностями кинетики образования твердой фазы.
Существуют вещества, которые в некотором интервале температур могут находиться в жидкокристаллическом состоянии (жидкие кристаллы), т.е. они одновременно обладают как свойствами жидкостей (высокая текучесть), так и кристаллических тел (анизотропия).
Аморфные тела (различные жидкости, пластические массы, смолы, стекло и др.) не имеют четко выраженной точки плавления и при повышении температуры они постепенно переходят в жидкое состояние.
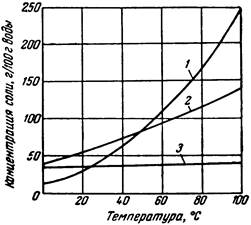
Рисунок 41.1 – Кривые растворимости в воде KNO3 (1), Ba(NO3)2 (2), NaCl (3).
Кристаллизация из растворов основана на ограниченной растворимости твердых веществ в воде или других растворителях.
Насыщенным называют такой раствор, который находится в равновесии с твердой фазой при данной температуре. Растворимость равна концентрации насыщенного раствора и зависит от температуры и свойств растворяемого вещества и растворителя. Для большинства веществ растворимость с повышением температуры возрастает, и о таких веществах говорят, что они обладают «положительной» растворимостью. Растворимость некоторых веществ «отрицательна», т. е. уменьшается с увеличением температуры. Кривая растворимости кристаллогидратов специфична и характеризуется наличием изломов. Для некоторых из таких веществ растворимость с повышением температуры на одних участках может увеличиваться, а на других – уменьшаться. На рис. 41.1 – 41.3 представлены диаграммы растворимости некоторых солей.
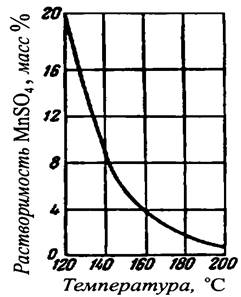
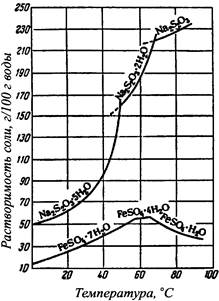
|
Рисунок 41.2 – Растворимость в воде MnSO4. |
Рисунок 41.3 – Кривые растворимости в воде тиосульфата натрия и сульфата закиси железа. |
При некоторых условиях концентрация растворенного вещества может быть больше его растворимости. Такие растворы называют пересыщенными. Они нестабильны и легко переходят в состояние насыщения, при этом из них выделяется в осадок часть твердой фазы, т.е. происходит процесс кристаллизации. Насыщенный раствор, полученный в результате выделения кристаллов, называют маточным раствором.
Массовую кристаллизацию проводят периодически или непрерывно следующими основными способами.
1. Охлаждением растворов для веществ, растворимость которых существенно
уменьшается при понижении температуры, например ![]() , и для
кристаллизации из расплавов – изогидрический
способ.
, и для
кристаллизации из расплавов – изогидрический
способ.
2. Испарением части растворителя, для веществ, растворимость которых
незначительно изменяется с изменением температуры, например ![]() ,– изотермический способ.
,– изотермический способ.
3. Комбинированным способом при одновременном охлаждении раствора и испарении части растворителя.
Кристаллизацию можно проводить также путем высаливания, т.е. добавления в раствор веществ, уменьшающих растворимость выделяемой соли. Если кристаллизация протекает с химической реакцией, то ее называют аддуктивной. При этом в раствор добавляют компонент, образующий с кристаллизуемым веществом комплексное соединение – аддукт, которое впоследствии термически разлагают с выделением целевого продукта.
Процесс кристаллизации обычно включает в себя стадии подготовки раствора (доведение до состояния пересыщения), собственно кристаллизации, выделения кристаллов, их промывку и сушку.
41.2. Равновесие при кристаллизации
Растворимость веществ существенно зависит от химической природы вещества и растворителя, температуры и давления. Как правило, растворимость большинства веществ увеличивается с повышением температуры. При снижении температуры растворимость таких веществ уменьшается, растворы становятся пересыщенными и переходят в состояние неустойчивого равновесия. Продолжительность и величина предельного пересыщения зависят от степени отклонения от равновесия, свойств компонентов системы, температуры раствора, скорости охлаждения, наличия примесей, внешних механических воздействий и других факторов. Переход из неравновесного состояния в равновесное сопровождается выделением кристаллов, т.е. кристаллизацией.
Зависимость между температурой кристаллизации индивидуальных веществ и давлением определяется уравнением Клаузиуса‑Клапейрона
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.