это означает, что даже слабые в воде кислоты будут сильными в аммиаке. По отношению к основаниям такой растворитель является дифференцирующим. Растворитель с кислыми свойствами (высокое сродство к OH-) – нивелирующий по отношению к основаниям и дифференцирующий по отношению к кислотам.
1938 г. Теория Льюиса:
Основание – вещество со свободной не поделённой электронной парой (донор электронной пары)
Кислота – вещество со свободной орбиталью (акцептор электронной пары).
Согласно этой теории H2O – основание.
Теория Усановича:
Кислота – вещество, способное отдавать катион, или присоединять анион
Основание – вещество, способное отщеплять анион, или присоединять катион.
17.11.2001
Ионные и средние ионные константы активности

Приготовить раствор, содержащий один вид ионов невозможно, следовательно, опытно всегда определяется a (активность) одних ионов в присутствии других. Таким образом было введено понятие о среднеионной активности электролитов, которая равна среднему геометрическому из активностей ионов.
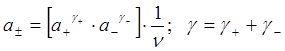 |
a2 можно определить различными способами из экспериментальных данных.
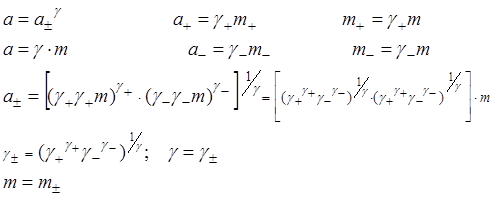
Симметричный электролит 1-1:
![]()
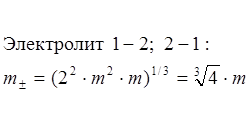 |
![]() Для несимметричных
электролитов
Для несимметричных
электролитов ![]() ; для несимметричных:
; для несимметричных:
Находится экспериментально из измерений ЭДС цепи без переноса вещества.
Строение растворов симметричных электролитов. Электростатическая теория сил электролитов (Дебая-Хюккеля)
Основана на одновременном учёте теплового движения ионов и их электростатическом взаимодействии с молекулами растворителя. Считается, что молекулы электролита полностью диссоциированы.
Основные постулаты: Наличие в растворе электролита ближайшей упорядоченности. Любой ион можно считать центром, вокруг которого находится ионная атмосфера их ионов противоположного знака.
Основные допущения (упрощения):
растворителя и раствора одинакова.
Цель выводов: рассчитать потенциал (L) данной точки раствора в зависимости от его свойств (c, T, …) с тем, чтобы получить значение энергии (E) электростатического взаимодействия ионов с ионной атмосферой и затем, определить средний ионный коэффициент активности.
Будем рассматривать ион, находящийся на расстоянии r от элемента объёма
![]()
![]()
![]()
![]()
dV Из распределения Больцмана можем получить
![]()
![]() r выражение
для плотности заряда в элементе V ионной
r выражение
для плотности заряда в элементе V ионной
атмосферы, находящейся на расстоянии r от
центрального иона
 |
n
|
Ионная атмосфера – тот объём раствора электролита, за пределам которого действие электростатического поля центрального иона и ионной атмосферы
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.