Компонент, реакция которого с одним из исходных веществ индуцирует превращение другого исходного вещества, называется индукотором. Исходное вещество, не реагирующее с индуктором – актор. Вещество, превращение которого в системе возможно только при наличии химической индукции называется акцептором.
![]()
![]() H2O2
+ Fe2+ Fe2++OH - + OH
H2O2
+ Fe2+ Fe2++OH - + OH
![]()
![]()
![]() C6H6 + OH C6H5
+ H20
C6H6 + OH C6H5
+ H20
![]()
![]()
![]() C6H5 + OH C6H50H
C6H5 + OH C6H50H
![]()
![]()
![]() C6H5 + C6H5
(C6H5)2
C6H5 + C6H5
(C6H5)2
Факторы индукции
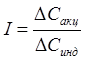
1. ΔСинд<0; I<0 – обычные затухающие реакции.
2. ΔСинд=const => I→0. Скорость реакций постоянна, они близки к каталитическим и коротким цепным реакциям. Отличие в том, что катализатор действует на реакции, у которых ΔG<0, т.е. лишь ускоряет реакции, которые с точки зрения термодинамики возможны, а индукторы позволяют проводить реакцию с ΔG>0, т.е. теоретически невозможные реакции, источником дополнительной энергии в данном случае является индукция.
3. ΔCинд>0; I>0 – самоиндукционные, или автокаталитические реакции.
Сопряжённые реакции не подчиняются принципу независимости скоростей.
Стадийность протекания реакций, метод квазистационарных
концентраций
В одну стадию протекает лишь очень малое число реакций, в большинстве случаев даже самая простая реакция описывается несколькими сложными дифференциальными уравнениями, решение которых весьма сложно, поэтому на практике для получения нужных результатов чаще всего используют другие методы.
Метод Ботернштейна
Если B – промежуточное вещество (радикал, атом, …,) обладает высокой реакционной способностью, то оно, едва образовавшись, начинает расходоваться. С какого-то момента скорость образования будет равна скорости расходования (состояние квазистационарных концентраций).
![]()
![]() A B D
A B D
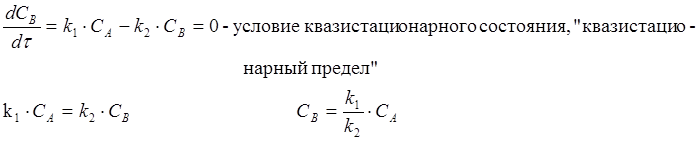
![]()
2N0 + O2 = 2NO2
Скорость этой реакции уменьшается с ростом температуры!!!???
Объяснение:
K1
![]()
![]() I. 2NO N202
I. 2NO N202
K-1
K2
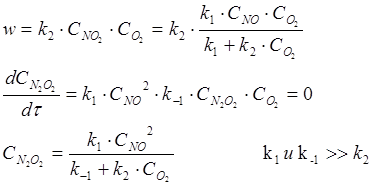
![]() II. N2O2
+ O2 2NO2
II. N2O2
+ O2 2NO2
![]()
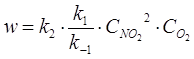 |
![]()
kравновесия
kравновесия убывает с ростом температуры быстрее, чем растёт k2 => общая зависимость от температуры – убывающая.
Механизм мономолекулярных реакций, протекающих по первому и второму порядку
![]() При p>6 гПа реакция протекает по первому порядку, при p<6 гПа по второму. Объяснение дал Линдеман с помощью
теории образования активных частиц.
При p>6 гПа реакция протекает по первому порядку, при p<6 гПа по второму. Объяснение дал Линдеман с помощью
теории образования активных частиц.
k1
![]()
![]() I. A + A A*
+ A
I. A + A A*
+ A
k2
k3
![]() II. A* P
II. A* P
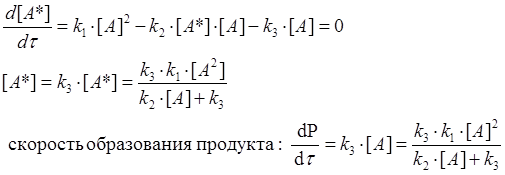
1. [A] => p<6 гПа => 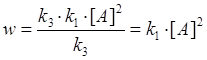 - реакция идёт по второму порядку.
- реакция идёт по второму порядку.
2.
[A] => p>6 гПа
=> 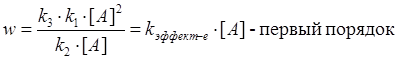
Зависимость скорости реакции от температуры. Уравнение Аррениуса
Экспериментально установлено, что скорость реакции возрастает с ростом температуры. Температура не влияет на концентрацию, а изменяет константу
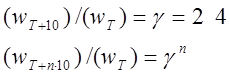 скорости реакции.
скорости реакции.
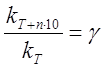 |
Аррениус предположил, что температурная зависимость константы аналогична уравнению изобары.
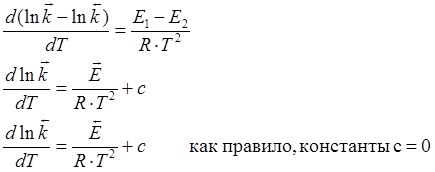
Eакт – та минимальная энергия, которой должна обладать реагирующая частица, чтобы при столкновении произошла реакция.
![]()
![]()
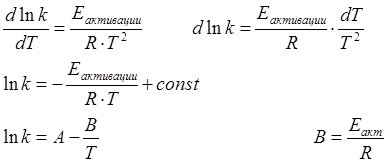
 ln k
ln k
![]()
![]() α
α
tgα=B
1/T
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.