3. Для любого процесса активным центром является ансамбль из определённого числа атомов катализатора.
Теория позволяет дать количественную оценку процессу катализа, она позволяет определить количественный состав активных центров, рассчитать общую и удельную активности катализатора. Двигаясь по площадке, атомы могут принимать конфигурацию, соответствующую конфигурации реагирующих молекул. При этом и возникает связь между атомами катализатора и реагирующей молекулы. Эта теория хорошо описывает окислительно-восстановительные реакции.
Pt
![]() SO2
+1/2 O2 SO3
SO2
+1/2 O2 SO3
![]() O
O
![]()
![]()
![]() 1. Pt + O2 Pt
1. Pt + O2 Pt
![]() O O
O O
![]()
![]()
![]() 2. Pt + SO3 SO3 +
PtO
2. Pt + SO3 SO3 +
PtO
O
![]() 3. PtO + SO2 SO3
+ Pt
3. PtO + SO2 SO3
+ Pt
Промоторы и ингибиторы. Отравления и регенерация катализатора
Промоторы – вещества, которые не являются катализаторами, но при добавлении к катализатору, они значительно увеличивают скорость реакции.
Ингибиторы – вещества, замедляющие реакцию.
Яды катализаторов – вещества, способные даже в малых количествах «отравлять» катализатор, т.е. приводить его в полную негодность или значительно снижать его эффективность, блокируя активные центры. Для любого катализатора существует целый набор ядов (часто это сера, тяжёлые металлы и др.).
Старение и усталость катализатора – явления, связанные с уменьшением поверхности при укрупнении мелкодисперсной системы (спекание, отложение посторонних веществ (примесей), перекристаллизация, и др.).
Регенерация катализатора – процесс восстановления свойств катализатора, через удаление ядов, примесей, восстановление пористости если адсорбция
обратима.
Электрохимия
Растворы электролитов и термодинамика гальванических элементов
Образование растворов электролитов, их коллигативные свойства. Влияние растворителя на диссоциацию.
Растворы электролитов являются проводниками второго рода (проводники первого рода – металлы, они проводят ток за счёт электронного газа (свободных электронов)). Электролиты проводят ток за счёт движения заряженных частиц – ионов. Электролиты при растворении диссоциируют на ионы.
Электролиты
Сильные Средние Слабые
Сильные – полностью диссоциируют на ионы. В твёрдом состоянии имеют кристаллическую решётку. При попадании в растворитель, начинают взаимодействовать с его молекулами. Энергия этого взаимодействия ион – молекула тем больше, чем больше полярность растворителя. Если эта энергия становится соизмеримой с энергией колебания ионов в кристаллической решётке, происходит переход ионов в раствор. Ион в растворе находится в сальвотированном состоянии (сольватация – взаимодействие иона с растворителем, окружающим его).
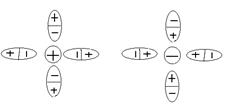
![]()
![]() ионы
ионы
молекулы полярного
![]() растворителя (воды),
растворителя (воды),
сольватная (гидратная, если это вода)
оболочка
Число молекул в сольватной оболочке зависит от размера иона и его заряда.
Взаимодействие сольватных ионов тем меньше, чем больше диэлектрическая
проницаемость среды (по закону Кулона). Существование ионов в растворе
подтверждено опытом по электропроводности, а также по изменению коллигативных свойств. Термодинамическая теория разбавленных растворов,
основанная на законе Разеля даёт коллигативные свойства.

![]()
![]() знак «=» ставим, для
идеальных растворов, в случае отклонения от идеальности (ассоциация или
диссоциация) величины
знак «=» ставим, для
идеальных растворов, в случае отклонения от идеальности (ассоциация или
диссоциация) величины ![]() ,
, ![]() и
и ![]() будут отличаться от вычисленных по
формулам. Для электролитов:
будут отличаться от вычисленных по
формулам. Для электролитов:
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.