![]()
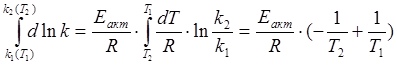
![]()
![]()
![]() E
E ![]()
![]()
Eакт прямой
Eакт обратной
ΔH<0 – тепловой эффект реакции (эндотермическая)
путь реакции
![]()
![]()
![]()
![]() E
E
Eакт обратной
![]()
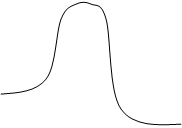
![]() Eакт
прямой
Eакт
прямой
ΔH>0
путь реакции
1. Теория активных соударений (ТАС).
2. Теория активированного комплекса ( переходного состояния) ТАК, ТПС.
Реакции, состоящие из одной стадии, называются элементарными. Каждая элементарная реакция складывается из большого числа элементарных актов. Задачи различных теорий – правильная интерпретация уравнения Аррениуса.
Положения и допущения:
1. В рамках ТАС считается, что элементарный акт превращения начальных веществ в конечные совершается в момент столкновения. В мономолекулярных реакциях сталкиваются две одинаковые молекулы. Тримолекулярные реакции можно рассматривать, как две бимолекулярные.
2. Не всякое соударение двух частиц приводит к реакции, а только когда движущиеся частицы обладают некоторым минимальным избытком энергии (Eакт). Число таких активных частиц определяется распределением Больцмана:
N*=N*exp(-Eакт/R*T). Вероятность активного соударения пропорционально числу активных частиц.
3. Частицы рассматриваются, как несжимаемые сферы с радиусом rA и rB, при этом одна из двух частиц принимается как точка, а размер другой равен rA+ rB.
4. Скорость химической реакции равна числу активных соударений. Площадь сечения соударения равна πd2.

![]()
![]()
![]()
![]()
![]() цилиндр
соударений, его диаметр d=2·dмолекулы
цилиндр
соударений, его диаметр d=2·dмолекулы

![]()
![]()
![]()
![]()
![]()
![]() α α
α/2 α α/2
α α
α/2 α α/2
12.11.2001
Стадии гетерогенного катализа. Теории
гетерогенного катализа.
![]()
![]() E
E
AB
![]()
![]()
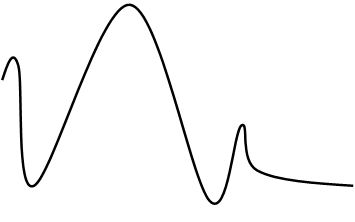 ABK*
ABK*
 |
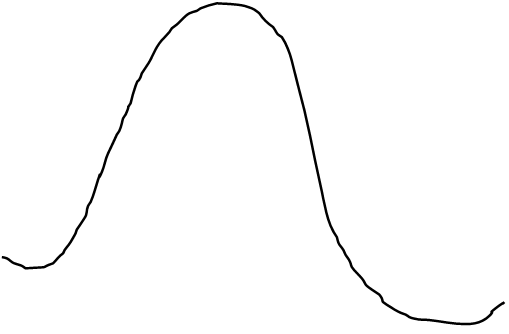
Eадсорбции Eпотенциальная
![]() A+B
A+B
 |
 ΔHадс-ции<0
ΔHр-ции
ΔHадс-ции<0
ΔHр-ции
![]()
![]()
![]() P
P
![]() ΔHдесорбции>0
ΔHдесорбции>0
координата (путь реакции)
Eдесорбции
Стадии:
1. Доставка реагента к поверхности катализатора
2. Адсорбция реагентов на поверхности катализатора
3. Непосредственно химическая реакция
4. Десорбция продуктов с поверхности катализатора
5. Отвод реагентов с поверхности катализатора в объём
Задача теории гетерогенного катализа – найти взаимосвязь между различными кинетическими и термодинамическими константами. Центральное место в этих теориях должно отводиться на модели поверхности катализатора.
Теория Тейлора 1926 г.: каталитическая активность возникает у атомов с ненасыщенными связями, реакции происходят на пиках и вершинах поверхности катализатора.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.