Существуют и макрометоды – например, нагружение полимера при деструкции.
Механизм термоокислительной деструкции полимеров
Стадии:
1. Инициирование – расщепление слабых связей под действием теплоты, света, нагрузки, …
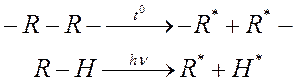 |
2. Развитие цепи (образование и распад гидроперекиси)
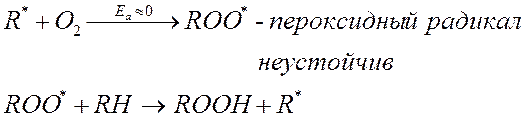 |
 Далее для твёрдого полимера многое
зависит от его структуры (например, иногда встречается очень пагубный процесс
образования гидроперекисных треков)
Далее для твёрдого полимера многое
зависит от его структуры (например, иногда встречается очень пагубный процесс
образования гидроперекисных треков)
В данном случае если удастся избежать протекание такого процесса, то устойчивость полимера значительно повысится (иногда для этого используется ориентация полимера, которая в служит не для увеличения устойчивости за счёт увеличения доли кристаллической фазы, а для создания внутренней структуры, которая позволила бы избежать образование треков.
Гидроперекись ROOH распадается на два радикала, являясь разветвляющим агентом, что приводит к зарождению новых кинетических цепей и лавинообразному нарастанию деструкции.
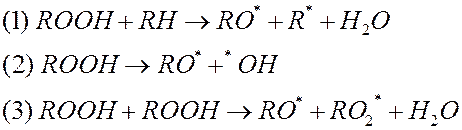 |
1- образуется алкоксильный и алкильный радикал и вода, такая реакция вероятна для веществ, содержащих подвижные атомы водорода при малой концентрации гидроперекиси (амины).
2- вероятна для одиночных гидроперекисей, образовавшихся в полимерах без подвижных атомов водорода
3- вероятна для полимеров, в которых образуются гидроперекисные треки (при большой концентрации гидроперекиси)
О протекании реакции по тому или иному механизму можно также судить по количеству выделившейся воды.
Фактически такой механизм приводит к обвальному цепному нестационарному процессу
3. Обрыв цепи:
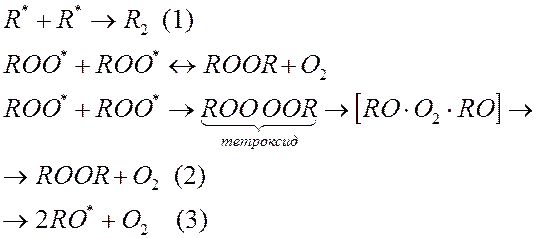 |
Т.к. присоединение кислорода к любым радикалам – очень выгодно (Ea ≈ 0), то гидроперекисных радикалов в полимере больше, чем алкильных в 100 ÷ 10000 раз и обрыв цепи по способу (1) маловероятен
Способ обрыва (2), или (3) зависят от подвижности цепей.
Реакции инициирования
(в отличие от фотодеструкции, рвётся связь R-R, а не R-H)
В твёрдофазных реакциях процесс инициирования осложняется клеточным эффектом:
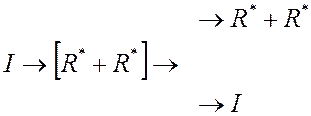
- разложение и об-
разование двух
![]() кинетических
цепей
кинетических
цепей
- регенерация
Клетка (имеет место, т.к. в твёрдом
полимере молекулы малоподвижны)
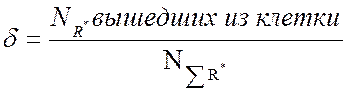 Существует параметр
эффективности инициирования:
Существует параметр
эффективности инициирования:
Эффективность инициирования определяется ингибиторным методом.
В гибкоцепных полимерах, δ → 1, а в твёрдых – может быть мала. Эффективность зависит от природы инициирующей частицы и макромолекулы, вязкости матрицы, химической природы, способа инициирования (термическое, фото ит.д.)
|
Среда |
δ |
|
|
ДАК |
ПС |
0,03 |
|
ДАК |
Этилбензол |
0,6 |
Из таблицы видно, что эффективность одного и того же стабилизатора в твёрдом полимере на порядок ниже, т.к. в нём из-за низкой молекулярной подвижности, многие радикалы рекомбинируют.
Существует два механизма выхода радикалов из клетки – диффузионный и эстафетный.
Диффузионный – выход за счёт обычного теплового движения (механизм характерен для жидкостей, расплавов и газов).
Эстафетный метод – основан на взаимодействии первичного радикала со стенками клетки (характерно для твёрдых стеклообразных полимеров).
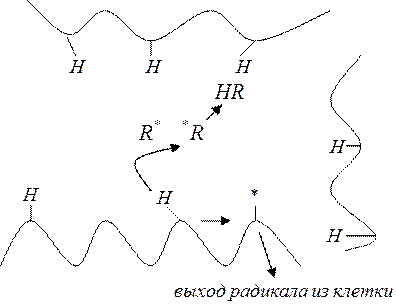
Влияющие факторы: устойчивость радикалов (устойчивые не склонны реагировать со стенками клетки, а стремятся материально диффундировать, реакционноспособные радикалы повышают вероятность эстафеты, на механизмы влияет молекулярная подвижность (приближение к ТВЭ увеличивает диффузию), подвижность водорода.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.