|
|
(16) |
Поскольку парциальное давление газа связано с общим давлением p и его объемным процентом очевидным равенством
|
|
(17) |
то уравнение (16) может быть представлено в виде
|
|
(18) |
поскольку ![]() .
.
Константа равновесия химической реакции является функцией температуры, поэтому фиксация T и общего давления p однозначно определяет состав газовой фазы, что и подтверждается правилом фаз Гиббса (12).
Изучаемая реакция
протекает с поглощением тепла (![]() ), и в соответствии с
уравнением изобары химической реакции
), и в соответствии с
уравнением изобары химической реакции
|
|
(19) |
ее константа равновесия увеличивается при возрастании температуры. Поэтому с ростом температуры при постоянном давлении происходит увеличение содержания СО в равновесной газовой фазе, то есть происходит смещение равновесия в сторону образования продукта реакции. Сказанное иллюстрирует рис. 2, на котором приведена температурная зависимость равновесного содержания СО в газовой фазе при различных давлениях в системе. Из анализа уравнения (18) следует, что с увеличением общего давления p имеет место снижение концентрации монооксида углерода при постоянной температуре.
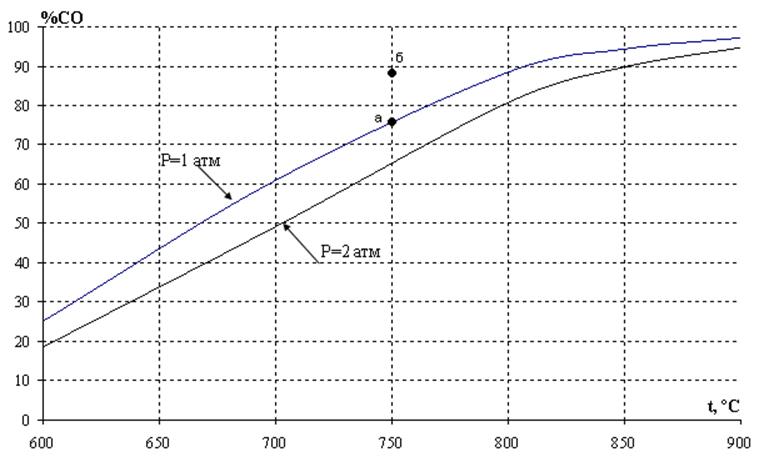
Рис.2. Зависимость равновесного содержания монооксида углерода от температуры при различных давлениях
Отмеченные
выше закономерности находятся в соответствии с принципом смещения равновесия
Ле-Шателье, согласно которому в равновесной системе при изменении внешних
параметров развиваются процессы, стремящиеся ослабить внешнее воздействие. Так,
росту температуры при постоянном давлении соответствует развитие
эндотермического процесса, то есть прямой реакции (11), а при изотермическом
увеличении внешнего давления в системе протекает обратный процесс (![]() ), сопровождающийся уменьшением числа
газовых молей.
), сопровождающийся уменьшением числа
газовых молей.
Возможность протекания реакции при фиксированной температуре в заданных условиях определяют по уравнению изотермы. Так, для условий точки б (рис. 2) исходное содержание монооксида углерода (%СОб) превышает равновесное (%СОа), поэтому величина ∆G для реакции (11)
|
|
(20) |
оказывается положительной. Другими словами, в условиях, характеризуемых параметрами точки «б», протекание прямой реакции невозможно, поэтому область, расположенная над изобарой pа, отвечает устойчивому существованию твердого углерода.
Расчет зависимости концентрации СО от температуры при постоянном давлении может быть проведен по уравнению (18) для чего необходимо рассчитать Kp при различных температурах с помощью выражения:
|
|
(21) |
ΔG0 находится по известному соотношению
|
|
(22) |
Тепловой эффект реакции и изменение энтропии в ходе реакции при заданной температуре рассчитывают по уравнениям:
|
|
(23) |
|
|
(24) |
используя справочные данные о теплотах образования, энтропии и теплоемкостях реагентов (прил. 1).
Среднюю величину теплового эффекта реакции в изученном интервале температур определяют графически по методике, приведенной в прил. 2.
Принципиальная схема установки представлена на рис. 3. Изучаемая реакция осуществляется в кварцевой ампуле 2, находящейся в печи электрического сопротивления 1, снабженной автоматическим регулятором температуры на базе потенциометра 4. Диоксид углерода, используемый в опыте и находящийся в камере 5, получается в аппарате Киппа при взаимодействии карбоната кальция с разбавленной (1:1) соляной кислотой. Наличие балластной камеры 5 объясняется необходимостью поддерживать постоянное давление. В изолированной системе при прохождении данной реакции давление будет увеличиваться, так как при протекании реакции увеличивается количество газовых молей. Постоянство давления обеспечивается благодаря тому, что объем балластной камеры 5 с давлением 1 атм много больше, чем объем реакционной камеры. В результате увеличение количества газовых молей при протекании реакции приводит к незначительному увеличению давления в системе, что позволяет считать давление в системе постоянным и равным 1 атм.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.