Измерение коэффициента
распределения позволяет определять активности растворенного вещества. Для этого
бинарный раствор с известной зависимостью активности компонентов от состава
приводят в контакт с несмешивающейся жидкостью, содержащей общий с первой фазой
компонент, активность которого неизвестна. После установления равновесия
измеряют концентрации ![]() и
и ![]() растворенного
вещества в каждой из фаз для растворов различного состава. Находят
соответствующие значения отношений
растворенного
вещества в каждой из фаз для растворов различного состава. Находят
соответствующие значения отношений ![]() и строят график
зависимости этого отношения от концентрации третьего компонента в растворах с
известными активностями. Экстраполируя полученную линию до нулевой концентрации
(
и строят график
зависимости этого отношения от концентрации третьего компонента в растворах с
известными активностями. Экстраполируя полученную линию до нулевой концентрации
(![]() ), на оси ординат получают значение
константы распределения для бесконечно-разбавленного раствора. Для таких
растворов, как уже отмечалось, отношение концентраций растворенного вещества не
зависит от состава растворов. Зная это отношение и величины активностей
растворенного вещества в одном из растворителей, рассчитывают активности
третьего компонента в другом растворителе при всех исследованных концентрациях.
), на оси ординат получают значение
константы распределения для бесконечно-разбавленного раствора. Для таких
растворов, как уже отмечалось, отношение концентраций растворенного вещества не
зависит от состава растворов. Зная это отношение и величины активностей
растворенного вещества в одном из растворителей, рассчитывают активности
третьего компонента в другом растворителе при всех исследованных концентрациях.
Закон распределения имеет и другое важное практическое значение. Из предыдущих уравнений следует, что для понижения концентрации растворенного вещества в одной фазе при постоянных температуре и давлении необходимо понизить его концентрацию в другой. Последнее может быть достигнуто разбавлением одной из фаз. В частности, при производстве стали для очистки металла от вредных примесей (фосфора, серы и др.) либо увеличивают количество шлака, либо удаляют шлак, содержащий вредную примесь, и наводят новый. Так как при постоянной температуре константа распределения примеси остается величиной постоянной, то часть примеси переходит из металла в новый шлак и концентрация ее в металле уменьшается. Такое извлечение растворенного вещества из раствора называется экстракцией.
Очевидно, экстракция
будет тем эффективнее, чем больше коэффициент распределения отличается от
единицы. Коэффициент распределения можно менять, добавляя в растворы вещества,
меняющие коэффициенты активности данного компонента «i». Так, введение вещества, имеющего
большее сродство к данному компоненту, чем растворитель, снижает коэффициент
активности этого компонента и, следовательно, изменяет величину коэффициента ![]() .
.
Порядок выполнения работы
Работа выполняется на виртуальной модели, которые часто применяются в случае, если изучение объекта экономически не обосновано, осложнено экспериментально или не безопасно. Виртуальная модель включает в себя смысловую модель, на основе которой разрабатывается математическая модель. По уравнениям мат. модели с помощью компьютера осуществляется графическое представление процесса.
Выполняемая виртуальная работа основана на реальном процессе выделения ионов меди из водного раствора при соприкосновении данного раствора с органической фазой представляющей собой раствор Д2ЭГФК ( Ди 2-этил-гексил фосфорная кислота) 30 мас.% в керосине. При протекании такого процесса основное количество Cu2+ переходит в органическую фазу, а концентрация Cu2+ в водном растворе существенно снижается.
Для выполнения работы следует подать в емкость 1 (Рис.8) по трубке 3 с помощью нажатия соответствующей кнопки-клапана необходимое кол-во водного раствора Vр (от 100 до 190 мл, синего цвета), добавить клапаном 4 жидкой органической фазы. После чего включить магнитную мешалку и перемешать растворы в течение 30 сек.
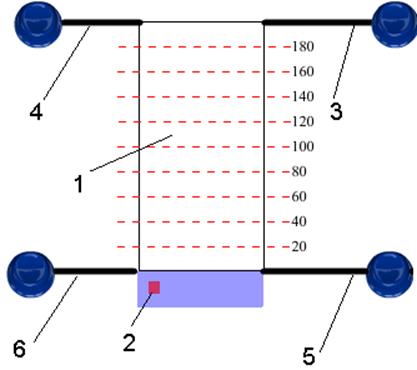
Рис. 8. Схема установки для разделения ионов меди между двумя несмешивающимися жидкостями: 1 – емкость для разделения (экстрактор), 2 – кнопка включения магнитной мешалки, трубки для подачи/слива: 3 – водного раствора содержащего ионы меди, 4 – органической фазы, 5 – на отбор проб для титрования, 6 – растворов в отстойник
Затем полученной эмульсии дают отстояться, и когда установятся два слоя, нижний (воду) в количестве 20 мл сливают нажатием на клапан трубки 5 в колбу для титрования 7 (Рис.9).
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.