|
|
(73) |
В разбавленных растворах
химический состав удобнее характеризовать величиной моляльности m , т.е. числом молей растворенного
вещества в 1000 г растворителя. Если раствор приготовлен из g1 граммов растворителя с молярной массой М1
и g2 граммов растворенного вещества с молярной массой M2,
то число молей компонента 2, приходящихся на I грамм растворителя, составит ![]() молей. Моляльность такого раствора
определяется равенством:
молей. Моляльность такого раствора
определяется равенством:
|
|
(74) |
Выразим мольную долю
компонента 2 через моляльность раствора. Так как в рассматриваемом растворе ![]() , то
, то
|
|
(75) |
Таким образом, с учетом (73) и (75) уравнение (72) принимает вид:
|
|
(76) |
Величину
|
|
(77) |
называют криоскопической постоянной растворителя, она зависит лишь от его природы и не зависит от концентрации и природы растворенного вещества. Согласно (76) понижение температуры кристаллизации разбавленного раствора прямо пропорционально числу растворенных частиц в 1000 г растворителя. Поэтому величина ΔT при заданной моляльности раствора будет зависеть и от степени диссоциации растворенного вещества.
Порядок выполнения работы
Понижение температуры кристаллизации раствора определяют с помощью установки, схема которой приведена на рис. 12.

Пробирку 1 с исследуемым раствором необходимо поместить в холодильник 2 и ввести в раствор «рабочий» конец термобатареи 3. Термобатарея представляет собой несколько последовательно включенных дифференциальных термопар (более 10 штук), которые многократно усиливают сигнал, получаемый от исследуемой системы. Другой конец термобатареи находится при комнатной температуре. В этом случае электрический сигнал с термобатареи характеризует температуру охлаждения раствора от времени. Типичный вид кривой охлаждения приведен на рис. 13.
Tемпературой начала кристаллизации раствора следует считать наивысшую температуру tнк (рис. 13), полученную после переохлаждения. Для ее точного определения следует внимательно следить за показаниями цифрового вольтметра 5. В области переохлаждения из раствора начинают выпадать кристаллы. Этот процесс сопровождается выделением тепла, а следовательно, повышением температуры до значения температуры начала кристаллизации (точка tнк на рис.13, кривая б). Таким образом, показания вольтметра сначала уменьшаются, (по абсолютному значению увеличиваются, так как измерение проходит в области температур пониженных относительно комнатной), затем увеличиваются до температуры начала кристаллизации, после чего снова уменьшаются – кривая б на рис. 13. Температуру кристаллизации растворителя определяют не менее трех раз. Для нагрева исследуемого раствора до исходной температуры используют стакан с горячей водой 4. Результаты измерений заносят в табл. 8.
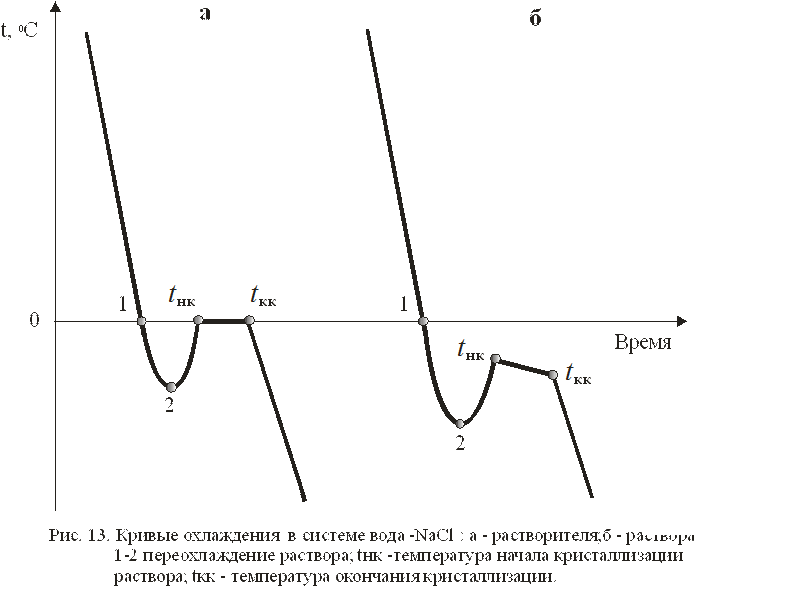
Таблица 8
Экспериментальные данные
|
№ опыта |
Концентрация растворенного вещества, мас. % |
Моляльная концентрация раствора (mi), моль/кг |
Температура кристаллизации растворителя |
Понижение температуры кристаллизации
|
|||
|
1 |
2 |
3 |
среднее
|
||||
|
1 2 … n |
|||||||
Понижение
температуры замерзания находят как разницу между температурой кристаллизации
чистого растворителя (![]() ) и температурой кристаллизации
растворителя из раствора (
) и температурой кристаллизации
растворителя из раствора (![]() ).
).
По данным табл. 8
строят график зависимости понижения температуры кристаллизации растворителя от
моляльной концентрации раствора. Угловой коэффициент полученной прямой
определяет опытное значение криоскопической постоянной (![]() ).
Его можно рассчитать по формуле
).
Его можно рассчитать по формуле
|
|
(78) |
где ![]() –
значения понижения температуры кристаллизации растворителя и моляльность
раствора в i-м опыте соответственно.
–
значения понижения температуры кристаллизации растворителя и моляльность
раствора в i-м опыте соответственно.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.