|
|
(35) |
Можно предположить, что система поглощает теплоту для преодоления энергии межчастичного взаимодействия в растворяемом веществе при его растворении. Однако, наряду с процессом «разрыва» химических связей обычно происходит и другой, называемый сольватацией. Сольватация представляет собой сильное взаимодействие растворяемого вещества с растворителем и сопровождается выделением тепла. Если растворителем является вода, сольватация называется гидратацией.
Роль подобного
взаимодействия растворителя с растворяемым веществом можно показать на примере
растворения хлорида натрия в воде. В кристаллической решетке хлорида натрия
катион натрия и анион хлора связаны друг с другом гетерополярной (ионной)
связью. Энергия, необходимая для их разделения, настолько велика, что такие
неполярные растворители как бензол, четыреххлористый углерод, не растворяют
хлорид натрия. Однако растворитель, подобный воде, молекулы которой обладают
высокой диэлектрической постоянной и большим дипольным моментом, сильно
«притягивается» как к ионам натрия, так и к ионам хлора. В итоге происходит
сольватация ионов, которая сопровождается значительным уменьшением энергии
системы. Если энергия, требуемая для отрыва ионов от кристалла, приблизительно
равна энергии сольватации, как в случае растворения NaCl в воде, значение суммарного теплового эффекта близко
к нулю. При растворении NaCl в
воде при 25ºС наблюдается лишь небольшое охлаждение, величина ![]() . При растворении же в воде Na2SO4 при 25ºC
выделяется тепло, потому что теплота гидратации (
. При растворении же в воде Na2SO4 при 25ºC
выделяется тепло, потому что теплота гидратации (![]() ) больше
энергии отрыва ионов от кристалла.
) больше
энергии отрыва ионов от кристалла.
Таким образом,
растворение твердой соли в воде может быть представлено как результат наложения
двух процессов. Переходя в жидкий раствор, соль изменяет агрегатное состояние,
становясь жидкой. При этом система поглощает тепло, равное теплоте плавления
соли (![]() ). Далее ионы соли после «плавления»
смешиваются с молекулами воды, причем тепловой эффект смешения (
). Далее ионы соли после «плавления»
смешиваются с молекулами воды, причем тепловой эффект смешения (![]() ) для солей, как правило, отрицателен (
) для солей, как правило, отрицателен (![]() ). Другими словами, знак суммарного
теплового эффекта (интегральной теплоты растворения) зависит от соотношения
величин
). Другими словами, знак суммарного
теплового эффекта (интегральной теплоты растворения) зависит от соотношения
величин ![]() и
и ![]() , так
как
, так
как
|
|
(36) |
Если растворять соли с общим катионом или анионом, то величина теплового эффекта будет определяться природой второго иона, входящего в соединение. Чем он сильнее (сила иона оценивается по отношению заряда к радиусу), тем прочнее связан в соединении, а значит, тем больше энергии требуется затратить на плавление (разрушение решетки соли). С другой стороны, более сильный ион образует более прочные связи с диполями воды, что увеличивает теплоту смешения. Общее изменение теплового эффекта при переходе от одной соли к другой будет определяться изменением теплот плавления и гидратации.
Методика проведения опытов
Для
определения интегральной теплоты растворения используется простейший
калориметр, состоящий из внутреннего 3 (рис. 6) и наружного стакана 1.
Сверху стаканы закрыты крышкой из материала с малой теплопроводностью. В крышке
имеются два отверстия: одно для воронки, через которую засыпают навеску соли, через
второе в термостат вводится термопарный датчик 4 (он позволяет находить
изменение температуры в процессе растворения соли). Перемешивание жидкости в
стакане 3 осуществляется магнитной мешалкой 2. Величины ЭДС датчиков
регистрируются цифровым вольтметром 5. Показания последнего заносятся в таблицу
первичной информации «![]() ».
».
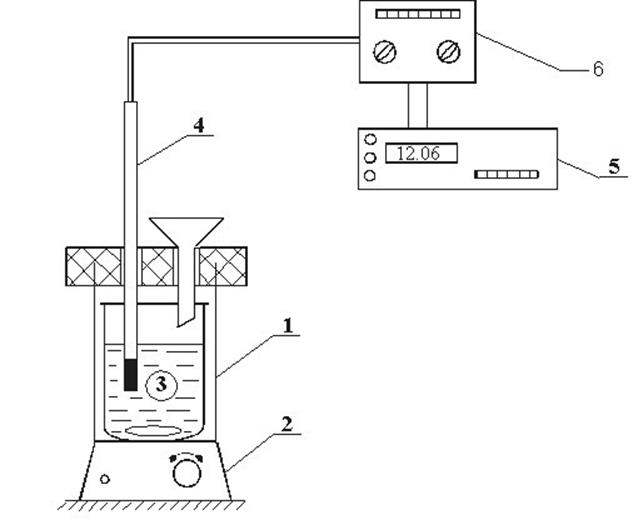
Рис.6. Схема установки для определения теплоты растворения: 1 – калориметр; 2 – магнитная мешалка; 3 – стеклянный стакан; 4 – термобатарея; 5 – вольтметр; 6 – усилитель сигнала
Используемые медь‑константановые
термопары обладают линейной зависимостью ЭДС от температуры, и значение
коэффициента ![]() в уравнении
в уравнении
|
|
(37) |
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.