указывается на используемом приборе. В
этом уравнении величина ![]() соответствует
температуре спаев термопар, находящихся вне калориметра, а
соответствует
температуре спаев термопар, находящихся вне калориметра, а ![]() – температура «рабочих» спаев, помещенных
в раствор.
– температура «рабочих» спаев, помещенных
в раствор.
Для проведения опытов необходимо приготовить навески солей в расчете на 300 мл воды при конечной концентрации соли, равной 0,20 М. Используемые соли должны быть сухими и тщательно растертыми в фарфоровой ступке. Наличие крупных кусочков соли увеличивает время растворения и приводит к дополнительным ошибкам в определении теплоты растворения.
После приготовления требуемых навесок солей во внутренний стакан наливают 300 мл дистиллированной воды, закрывают термостат крышкой, включают магнитную мешалку и фиксируют в течение 7 минут показания приборов. При использовании цифрового вольтметра 5 удобнее записывать в таблицу величины через каждую минуту. Далее, на седьмой минуте следует засыпать соль и продолжать фиксировать показания прибора. После введения соли рекомендуется 4-6 замеров сделать через 30 секунд, а остальные – через минуту, закончив замеры через 10-12 минут после засыпки соли.
Расчет интегральной теплоты растворения производят по формуле
|
|
(38) |
где ![]() –
постоянная калориметра;
–
постоянная калориметра; ![]() – изменение температуры
при растворении;
– изменение температуры
при растворении; ![]() – молекулярный вес соли;
– молекулярный вес соли; ![]() – навеска соли в граммах.
– навеска соли в граммах.
Постоянная калориметра
характеризует количество тепла, необходимое для повышения температуры внутри
калориметра на один градус. Её определяют, внося в калориметр фиксированное
количество тепла (например, пропуская через электрическое сопротивление ток в
течение определенного времени) и определяя одновременно повышение температуры.
Численное значение постоянной дается преподавателем или определяется студентами
по величине ![]() растворения «стандартной» соли.
растворения «стандартной» соли.
Изменение температуры ![]() при растворении определяют графически.
Поскольку температура раствора пропорциональна величине измеряемой ЭДС, строят
график непосредственно в координатах «
при растворении определяют графически.
Поскольку температура раствора пропорциональна величине измеряемой ЭДС, строят
график непосредственно в координатах «![]() ».
».
Из графика следует, что
время опыта делится на три периода. В первом периоде до момента засыпки соли (![]() ) наблюдается равномерное увеличение
температуры (ЭДС) за счет выделения тепла при вращении мешалки в воде. При
добавлении соли в момент
) наблюдается равномерное увеличение
температуры (ЭДС) за счет выделения тепла при вращении мешалки в воде. При
добавлении соли в момент ![]() наблюдается интенсивное
снижение температуры и по окончании растворения (
наблюдается интенсивное
снижение температуры и по окончании растворения (![]() )
наблюдается ее монотонное увеличение.
)
наблюдается ее монотонное увеличение.
Очевидно, что в процессе
растворения раствор обменивается теплом со средой, поэтому для расчета ![]() необходимо по опытным данным построить
гипотетическую зависимость
необходимо по опытным данным построить
гипотетическую зависимость ![]() для «мгновенного»
растворения.
для «мгновенного»
растворения.
|
|
(39) |
С этой целью определяют
время конца растворения ![]() как точку, в которой
зависимость «
как точку, в которой
зависимость «![]() » становится линейной. По графику находят
середину второго периода и восстанавливают перпендикуляр к оси абсцисс до
пересечения с продолжением линии равномерного изменения температуры (ЭДС) в I и III периодах. Определив таким методом величину
» становится линейной. По графику находят
середину второго периода и восстанавливают перпендикуляр к оси абсцисс до
пересечения с продолжением линии равномерного изменения температуры (ЭДС) в I и III периодах. Определив таким методом величину ![]() и зная температурный коэффициент
термопары, рассчитывают понижение температуры
и зная температурный коэффициент
термопары, рассчитывают понижение температуры
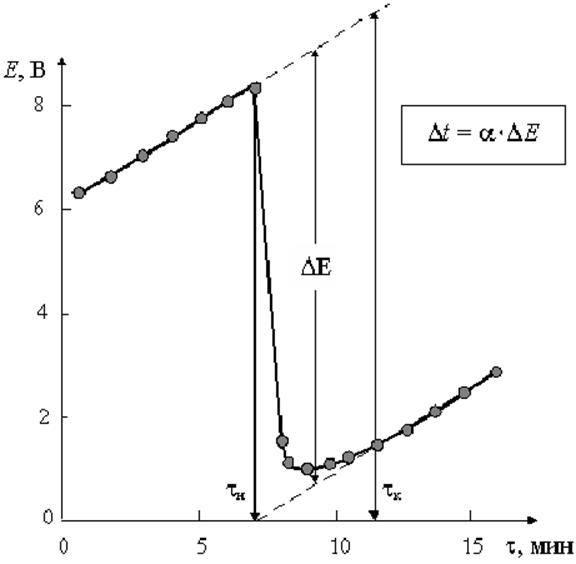
Рис.7. Зависимость E от времени наблюдения. По изменению ЭДС – ΔE находят Δt
Найденные опытным путем теплоты растворения солей вносят в таблицу 4 и оценивают абсолютную и относительную погрешности их определения, сопоставляя полученные результаты с табличными данными, приведенными в прил. 3 настоящего руководства.
Исследуемая соль |
Теплота растворения, кДж/моль |
|
|
|
Справочные данные |
|
||
Отчет о работе завершают выводами.
1. Что называют интегральной и дифференциальной теплотами растворения?
2. Как связана прочность кристаллической решетки соли и теплота ее растворения?
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.