атомов в согласии с принципом исключения Паули и правилом Гунда. Правило Гунда определяет порядок заполнения оболочек, при котором атом находится в устойчивом состоянии, в состоянии с наименьшей энергией.
Отметим некоторые особенности свойств атомов с различным числом электронов. Так уровни энергии в атомах с различным порядковым номером (зарядом ядра Z) различаются только масштабом, т.к.
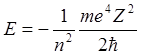 .
.
Т.е. уровни энергии в различных атомах соответствуют их расположению в атоме водорода.
Другой важный фактор, который определяет химические, оптические и другие свойства атомов, это экранировка заряда ядра электронами ниже лежащих электронных оболочек. Вследствие экранирующего влияния орбит друг на друга истинные волновые функции менее сконцентрированы около ядер, чем можно было бы ожидать на основании водородоподобных волновых функций. Так все уровни энергий лития расположены несколько ниже эквивалентных уровней водорода. Насколько значительна экранировка ниже лежащими электронами можно судить по эффективному заряду ядра, вычисленному из экспериментального значения первой энергии ионизации по уравнению:
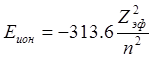 .
.
Такие данные представлены в табл. 5.1.
|
атом |
H |
He |
Li |
Be |
B |
C |
N |
O |
F |
Ne |
|
Zэф |
1.00 |
1.34 |
1.26 |
1.66 |
1.56 |
1.82 |
2.07 |
2.00 |
2.26 |
2.52 |
|
r,
|
0.76 |
0.59 |
2.52 |
1.92 |
1.70 |
1.45 |
1.28 |
1.32 |
1.17 |
1.05 |
Важным свойством электронного строения атомов является то, что полностью заполненные оболочки, на которых все электроны спарены и полный магнитный момент равен нулю, особенно устойчивы и практически не участвуют во взаимодействиях с другими электронами как данного атома, так и других атомов. Поэтому химическое поведение атома определяется только внешними электронами, не заполнившими полностью свою оболочку. Как известно, валентность элементов равна либо числу электронов незаполненной оболочки, либо числу недостающих до полного заполнения электронов. Из этой особенности возникает периодичность свойств элементов в таблице Д.И. Менделеева. При одинаковом числе внешних валентных электронов химические свойства практически не зависят от числа электронов, заполняющих внутренние оболочки. Наличие и строение внутренних оболочек сказывается только на рентгеновских спектрах.
Следует отметить, что химические свойства элементов зависят не только от электронной конфигурации основного состояния атома, но также и от потенциалов возбуждения и ионизации. Если для первых пяти элементов возможно только одно атомное состояние с электронной конфигурацией, соответствующей наинизшему энергетическому состоянию, и их возбужденные состояния по энергии сильно отличаются от основного состояния, то у некоторых других элементов иная ситуация. Так у атома углерода 2 р-электрона с главным квантовым числом n = 2 могут давать различные значения результирующих квантовых чисел S и L и соответствующие им термы: 3Р(S = 1, L = 1), 1D (S = 0, L = 2), 1S (S = 0, L = 0), 1Р (S = 0 , L = 1). Наиболее устойчивое (с наинизшей энергией) состояние атома углерода 3Р. Но значительно чаще у углерода проявляется возбуждённое состояние 5S (2s,3p3), для перехода в которое необходима относительно небольшая энергия 4.3 эВ.
Таблица 5.2. Термы атома углерода и их энергетические характеристики (эВ).
|
Уровни |
Число электронов |
Терм |
Энергия возбужд. состояния |
Отсчёт от уровня вакуума |
|
2s 2p |
2 2 |
P |
0 |
- 11.2 |
|
2s 2p |
1 3 |
S |
4.3 |
- 6.9 |
|
2s 2p 3s |
2 1 1 |
P |
7.4 |
- 3.8 |
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.