Следует отметить, что величина А довольно значительна; она определяется кулоновским взаимодействием электронов и близка к потенциальной энергии отталкивания электронов (+е2/r). Поэтому синглет-триплетное расщепление по величине того же порядка, что и расстояние между самими уровнями. При таком подходе расхождение теоретических расчетов от эксперимента составляет 20-30 %.
5. СТРОЕНИЕ АТОМА И ПЕРИОДИЧЕСКИЙ ЗАКОН
5.1. Атомные орбитали.
Основные положения при описании строения атома:
1. Каждый электрон в атоме может быть представлен волновой функцией (ВФ), называемой атомной орбиталью (АО). АО можно определить, решая уравнение Шредингера.
2. Каждая АО характеризуется набором квантовых чисел:
n - главное квантовое число определяет энергию (Е) и радиус орбитали (r = 1/a):
Е = -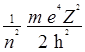 ; а =
; а = 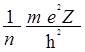 .
.
Поэтому об электронах, находящихся на АО с одинаковым n говорят как об электронах одной оболочки.
n 1 2 3 4 5 6 7
Обозначение K L M N O P Q
оболочки
- l – азимутальное квантовое число, которое может принимать значения от 0 до lmax. lmax = n - 1. Электронные уровни с различными значениями l обозначаются:
l 0 1 2 3
Обозначение s p d f
- m – магнитное квантовое число. Оно принимает значения от - lmax до +lmax.
-
s - спиновое квантовое число. s =![]() .
.
Важное значение для образования химической связи имеет распределение в пространстве амплитуды волновой функции Y(x,y,z), а также вероятности нахождения электрона Y2(x,y,z). На рис.5.1 представлены изоамплитуды для электрона в атоме, находящимся в различном состоянии (на различных АО).
3. Каждой АО отвечает вполне определенная энергия, которая вычисляется в результате решения волнового уравнения. Электронные переходы между АО сопровождаются поглощением или испусканием кванта электромагнитного излучения с энергией: E1 - E2 = hn.
4. Принцип исключения Паули. В одном атоме не может быть двух электронов с одинаковым набором четырех квантовых чисел. Или - полная волновая функция для электронов должна быть асимметричной.
5. Атомные оболочки заполняются таким образом, что энергия атома всегда минимальна при данном количестве электронов. Порядок заполнения атомных орбиталей определяется правилом Клечковского: АО располагаются по ряду s-, p-, d-, f- и т.д., но в последовательности возрастания суммы квантовых чисел (n + l). Если сумма равна, то сначала заполняются уровни с меньшим значением n.
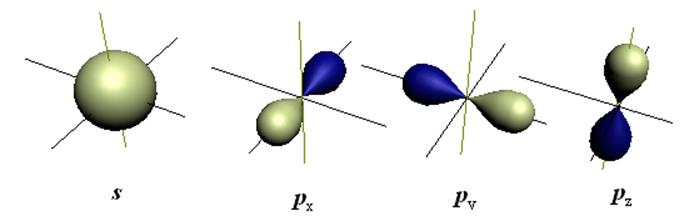
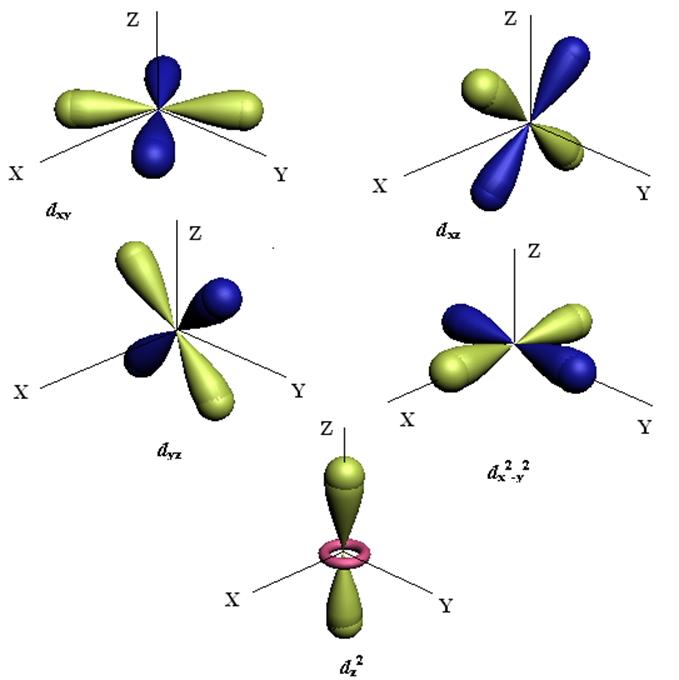
Рис.5.1 Формы амплитуды ВФ атомных орбиталей электрона для различных состояний.
5.2. Периодический закон.
Периодический закон был открыт Д.И. Менделеевым в 1869 г. В то время до квантовой химии и современного представления о строении атомов было далеко. Однако гениальный русский химик расположил элементы в своей таблице в соответствии со строением электронных оболочек.
В периодической таблице элементов Д.И. Менделеева с увеличением заряда ядра происходит последовательное заполнение электронных оболочек
Таблица 5.1. Порядок заполнения атомных орбиталей.
|
n + l |
n |
l |
Электронная конфигурация |
№ АО |
|
1 |
1 |
0 |
1s |
1 |
|
2 |
2 |
0 |
2s |
2 |
|
3 |
2 |
1 |
2p |
|
|
3 |
0 |
3s |
3 |
|
|
4 |
3 |
1 |
3p |
|
|
4 |
0 |
4s |
4 |
|
|
5 |
3 |
2 |
3d |
|
|
4 |
1 |
4p |
||
|
5 |
0 |
5s |
5 |
|
|
6 |
4 |
2 |
4d |
|
|
5 |
1 |
5p |
||
|
6 |
0 |
6s |
6 |
|
|
7 |
4 |
3 |
4f |
|
|
5 |
2 |
5d |
||
|
6 |
1 |
6p |
||
|
7 |
0 |
7s |
7 |
|
|
8 |
5 |
3 |
5f |
|
|
6 |
2 |
6d |
||
|
7 |
1 |
7p |
||
|
8 |
0 |
8s |
8 |
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.